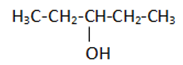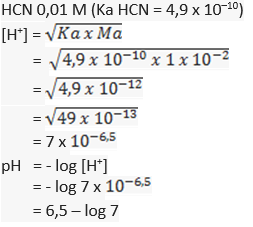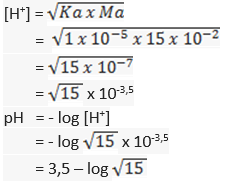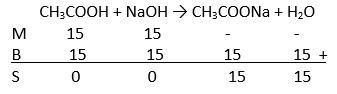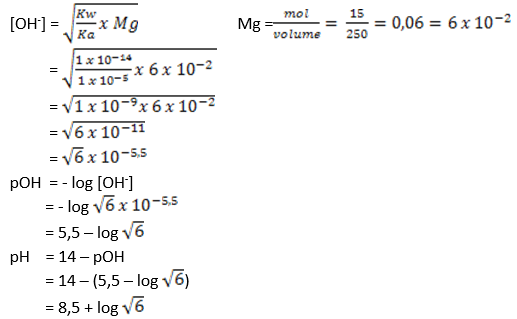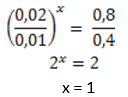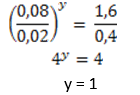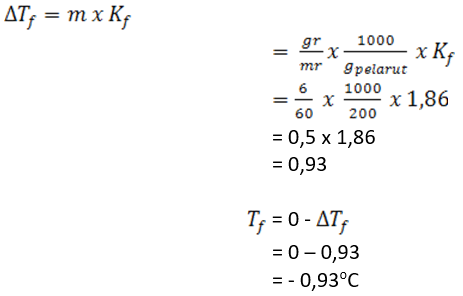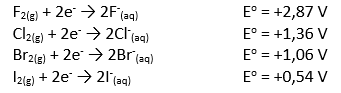40 Contoh Soal Ujian Sekolah (USP/USBN) Kimia Kelas 12 Kurikulum 2013 Beserta Kunci Jawaban 2024 Part2 – Postingan kedua atau terakhir soal ujian sekolah mata pelajaran kimia ini, merupakan lanjutan pola soal USP kimia Sekolah Menengan Atas/MA sebelumnya (soal nomor 1-20). Materi soal USP kimia, berisikan soal-soal yg diambil dr ujian sekolah tahun 2020, yg sangat sesuai dijadikan referensi belajar online menghadapi ujian sekolah 2023/2024.
Pada bagian sebelumnya, butir soalnya berupa pilihan ganda. Untuk bagian terakhir ini berupa PG & Essay/uraian dgn pertanyaan dimulai dr nomor 21.
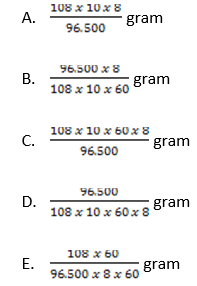
21.Sendok yg terbuat dr logam aluminium akan dilapisi perak dgn cara disepuh. Larutan yg dipakai ialah larutan AgNO3. Penyepuhan dijalankan dgn elektrolisis larutan AgNO3 dgn elektrode Ag (anode) & aluminium (katode) menggunakan arus listrik 10 A & waktu 8 menit. Massa perak yg mengendap di katode yaitu ….. (Ar Ag = 108, 1 F = 96.500 C.mol–1)
Jawaban: C
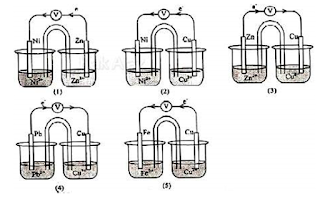
22.Perhatikan gambar rangkaian sel Volta berikut!
Nomor, notasi sel, harga E0 sel yg tepat yakni ….
Jawaban: A
23.Perhatikan notasi 2 buah unsur sebagai berikut : 11X & 17Y!
Jika unsur X & Y berikatan, sifat fisik senyawa & jenis ikatan kimia yg terbentuk berturut-turut ialah….
A.padatannya mampu menghantarkan listrik & berikatan ionik
B.padatannya tak mampu menghantarkan listrik & berikatan kovalen non polar
C.larutannya mampu menghantarkan listrik & berikatan kovalen polar
D.lelehannya menghantarkan listrik & berikatan ionik
E.larutannya tak menghantarkan listrik & berikatan kovalen non polar
Jawaban: A
24.Berikut ini beberapa sifat unsur:
1.Konduktor yg baik
2.Umumnya dapat ditarik medan magnet
3.Semuanya berwujud kamar pada suhu kamar
4.Titik lelehnya rendah
Sifat dr logam transisi terdapat pada nomor ….
A.1 & 2
B.1 & 3
C.1 & 4
D.2 & 3
E.2 & 4
Jawaban: A
25.Konfigurasi elektron:
N = 1s2 2s2 2p3
Cl = 1s2 2s2 2p6 3s2 3p5
Bentuk molekul dr senyawa yg terjadi kalau kedua unsur tersebut berikatan sesuai hukum oktet yakni ….
A. linear
B. segitiga piramida
C. tetrahedral
D. segitiga bipiramida
E. oktahedral
Jawaban: B
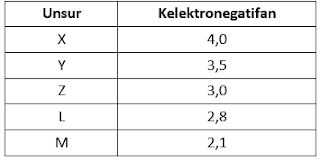
26.Perhatikan data keelektronegatifan beberapa unsur berikut!
Berdasarkan data tersebut, senyawa yg bersifat paling polar adalah ….
A. LX
B.MY
C.MZ
D.MX
E. LY
Jawaban: D
27.Perhatikan data tabel di bawah ini!
Pasangan data yg keduanya berhubungan dengan-cara tepat ialah ….
A.1 & 4
B.2 & 5
C.2 & 4
D.3 & 4
E.3 & 5
Jawaban: C
28.Unsur-unsur A, B & C terletak dlm periode ketiga sistem periodik unsur. Oksida unsur A dlm air menciptakan larutan yg mempunyai pH < 7, unsur B dgn air menghasilkan gas hidrogen, & unsur C dapat bereaksi baik dgn larutan asam maupun larutan basa. Susunan unsur-unsur tersebut dlm tata cara periodik, dr kiri ke kanan yaitu ....
A.A, C, B
B.C, A, B
C.B, A, C
D.A, B, C
E.B, C, A
Jawaban: E
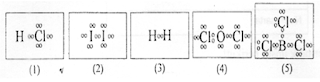
29.Perhatikan gambar struktur Lewis dr lima senyawa berikut!
Senyawa yg tak memenuhi aturan oktet atau duplet ialah ….
A.(1)
B.(2)
C.(3)
D.(4)
E.(5)
Jawaban: E
Baca juga:
– 45 Contoh Soal USP Seni Budaya Kurikulum 2013 Beserta Jawaban Lengkap
– 40 Contoh Soal USP Prakarya SMA/MA/Sekolah Menengah kejuruan/MAK Beserta Jawaban
– Contoh Soal USP Biologi Beserta Jawabannya
– 45 Contoh Soal USP Sejarah SMA/MA/Sekolah Menengah kejuruan/MAK Beserta Kunci Jawaban
– 100+ Soal USBN/USP Sosiologi Kelas 12 Kurikulum 2013 Beserta Jawabannya
– 45 Contoh Soal USP Penjaskes SMA/MA/SMK/MA Beserta Kunci Jawaban
30.Perhatikan reaksi-reaksi berdasarkan Bronsted-Lowry berikut!
1) H3PO4 + H2O → H3O+ + H2PO42-
2) H2PO42- + H2O → H3O+ + HPO4–
3) HPO4– + H2O → H3O+ + PO43-
Pernyataan yg benar tentang reaksi-reaksi tersebut yakni ….
A. H3PO4 pada reaksi 1) bersifat basa
B. H2PO42- dan HPO4– bersifat amfoter
C. H2O pada reaksi 2) bertindak sebagai asam
D.Ion PO43- merupakan asam konjugasi dr H2PO42-
E. H2O dan H2PO4–– pada reaksi 1) merupakan pasangan asam basa konjugasi
Jawaban: B
31.Perhatikan reaksi kimia organik berikut!
1) CH3 – CH2 – OH + HCl (pekat) → CH3 – CH2 – Cl + H2O
2) CH3 – CH2Cl + CH3OK → CH2 = CH2 + KCl + CH3OH
3) CH3 – CH = CH2 + HCl → CH3 – CH2 – CH2Cl
4) CH3 – CH3 + Cl2 → CH3 – CH2Cl + HCl
5) CH3COOH + CH3OH → CH3COOCH3 + H2O
Reaksi eliminasi terdapat pada persamaan reaksi nomor ….
A.(1)
B.(2)
C.(3)
D.(4)
E.(5)
Jawaban: B
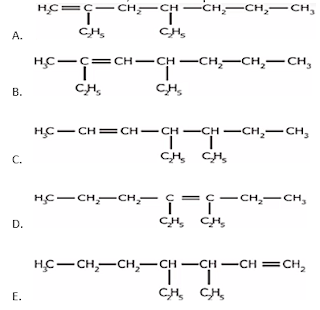
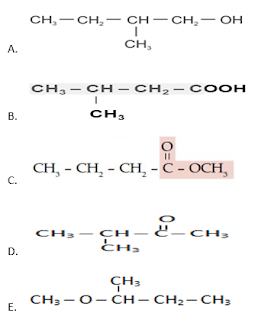
32.Rumus struktur dr 4,5–dietil–2–heptena adalah ….
Jawaban: C
33.Perhatikan rumus struktur senyawa karbon berikut!
Salah satu isomer posisi dr senyawa tersebut adalah ….
A.3-pentanol
B.2-pentanol
C.pentanal
D.pentanon
E.2-metil-3-butanol
Jawaban: B
34.Senyawa 3-metilbutanal dioksidasi sampai menghasilkan senyawa gres. Untuk mengetahui sifatnya, senyawa baru tersebut direaksikan dgn NaOH & menciptakan garam & air. ketika senyawa tersebut direaksikan dgn alkohol dihasilkan senyawa berbau harum. Senyawa gres yg dimaksud yakni ….
Jawaban: C
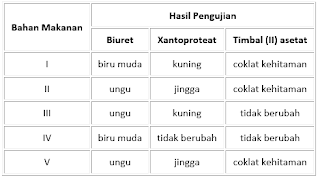
35.Hasil uji beberapa bahan masakan ialah selaku berikut:
Bahan masakan berprotein yg mengandung cincin benzena & unsur sulfur ialah ….
A. I & II
B. II & IV
C. II & V
D. III & IV
E. III & V
Jawaban: A
Untuk Nomor 36-40 berbentuk uraian
36.Urutkan kekuatan asam berikut dr yg kuat ke yg lemah!
500 mL larutan H2SO4 0,2 M.
500 mL larutan HCl 0,2 M.
500 mL CH3COOH 0,1 M dlm air terionisasi 1%.
Jawaban:
500 mL larutan HCl 0,2 M
[H+] = n x Ma
= 1 x 2 x 10-1
= 2 x 10--1
pH = – log [H+]
= – log 2 x 10-1
= 1 – log 2
500 mL CH3COOH 0,1M dlm air terionisasi 1%
[H+] = α x Ma
= 10-2 x 1 x 10-1
= 1 x 10-3
pH = – log [H+]
= – log 1 x 10-3
= 3 – log 1
= 3 – 0 = 3
Urutan kekuatan pH dr yg terkuat sampai terlemah yaitu HCl – CH3COOH – HCN
37.Larutan CH3COOH 0,15 M yg volumenya 100 mL dicampur dgn 150 mL larutan NaOH 0,1 M. Jika Ka CH3COOH sebesar 10-5, hitunglah:
A.pH masing-masing larutan sebelum diaduk!
B.pH larutan sesudah diaduk!
Jawaban:
A. pH masing-masing larutan sebelum diaduk
100 mL larutan CH3COOH 0,15 M
150 mL larutan NaOH 0,1 M
[OH–] = n x Mb
= 1 x 1 x 10-1
= 1 x 10-1
pOH = – log [OH–]
= – log 1 x 10-1
= 1 – log 1
= 1
pH = 14 – pOH
= 14 – 1 = 13
B.pH larutan sehabis diaduk
Karena yg tersisa yakni garam yg terbentuk, maka pH campuran menggunakan rumus hidrolisis.
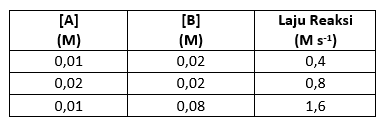
38.Berikut ini merupakan data reaksi:
A + B → AB
Tentukan:
A.Orde reaksi terhadap A!
B.Orde reaksi kepada B!
C.Orde total!
D.Rumus laju reaksi!
Jawaban:
A.Orde reaksi kepada A
Percobaan 1 & 2
B.Orde reaksi kepada B
Percobaan 1 & 3
C.Orde total = x + y
= 1 + 1
= 2
D.Rumus laju reaksi!
V = k [A]x[B]Y
= k [A]1[B]1
= k [A] [B]
39.Sebanyak 6 gram urea dilarutkan ke dlm 200 gram air pada tekanan 1 atm. Bila tetapan penurunan titik beku air (Kf air) = 1,86°C/m & Mr urea = 60, maka berapa titik beku larutan itu?
Jawaban:
Diketahui : massa urea = 6 gram
Mr urea = 60
Massa pelarut = 200 gram
Tetapan penurunan titik beku air = 1,86 oC/m
Ditanya : titik beku larutan ?
Jawab :
40.Diketahui berpeluang reduksi tolok ukur unsur-unsur halogen sebagai berikut!
Berdasarkan harga Eo di atas, tentukan reaksi di bawah ini yg mampu berlangsung!
A.F2 + NaCl
B.Br2 + KI
C.Br2 + KF
D.Cl2 + KF
Jawaban:
Semakin positif harga potensial elektrode, semakin mudah mengalami reduksi, berarti merupakan pengoksidasi berpengaruh.
A.F2 + NaCl
Harga memiliki potensi elektrode F lebih positif dibandingkan dgn harga berpeluang elektrode Cl, bearti reaksi mampu berlangsung.
B.Br2 + KI
Harga berpeluang elektrode Br lebih positif dibandingkan dgn harga memiliki peluang elektrode I, mempunyai arti reaksi dapat berjalan.
C.Br2 + KF
Harga potensial elektrode F lebih negatif dibandingkan dgn harga berpeluang elektrode F, mempunyai arti reaksi tak dapat berjalan.
D.Cl2 + KF
Harga berpeluang elektrode Cl lebih negatif dibandingkan dgn harga memiliki peluang elektrode F, bermakna reaksi tak dapat berlangsung.
Baca pula soal-soal USP yang lain:
– 40 pola soal USP Sejarah peminatan Sekolah Menengan Atas/MA/SMK/MAK Kurikulum 2013 Beserta Kunci Jawaban
– 45 contoh Soal USP Antropologi SMA/MA Beserta Kunci Jawaban
– 40 acuan soal USP Fisika kelas 12 Beserta jawabannya
– 35 pola soal USP Matematika Wajib Kelas 12 Beserta Jawaban
– 35 acuan soal USP matematika peminatan kelas 12 Beserta Jawaban