Di alam terdapat banyak senyawa dengan karakteristik masing-masing. Adanya kesamaan karakteristik mengakibatkan kita gampang untuk mengelompokkan senyawa-senyawa yang ada.
Misalnya, senyawa organik dan senyawa anorganik. Setiap senyawa memiliki nama spesifik untuk membedakannya dari senyawa lain.
Penulisan namanya dapat dituliskan secara sistematik atau berdasarkan IUPAC-International Union of Pure and Applied Chemistry), maupun ditulis berdasarkan nama lazim (nama jualan ).
Pada peluang kali ini, kita akan membicarakan bagaimana cara penulisan tata nama dari senyawa-senyawa yang telah disebutkan di atas secara sistematik.
Daftar Isi
Tata Nama Senyawa Organik
Senyawa organik yakni senyawa kimia yang mengandung karbon yang mempunyai sifat-sifat tertentu, kecuali karbida, karbonat, dan oksida karbon.
Dalam sistem penamaannya, senyawa organik relatif lebih kompleks ketimbang senyawa anorganik.
Tidak hanya berdasarkan rumus molekulnya, tetapi juga berdasarkan rumus struktur kimia dan gugus fungsinya.
Dalam bagian ini, cuma akan dibahas cara penamaan senyawa organik yang sederhana.
| Gugus Fungsi*) | Rumus Senyawa | Rumus Struktur*) | Nama IUPAC |
| Alkana | CH4 | 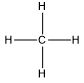 |
Metana |
| Keton / Alkanon | C3H6O | 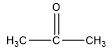 |
2-propanon |
| Alkena | C5H10 | 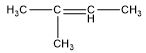 |
2-metil-2-pentena |
| Alkohol / Alkanol | C4H9OH | 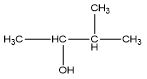 |
3-metil-2-butanol |
| Aldehida / Alkanal | CH2O | |
Metanal |
| dll. |
*) Masih banyak lagi
Baca juga Koloid.
Tata Nama Senyawa Anorganik
Senyawa anorganik yakni senyawa kimia yang tidak mengandung karbon. Senyawa anorganik dikelompokkan menjadi senyawa ion, senyawa molekul, dan asam.
1. Senyawa Ion
Senyawa ion terdiri dari kation (komponen logam) dan anion (unsur non logam atau poliatom). Senyawa ion dapat berupa senyawa basa maupun garam. Rumus senyawa ion diputuskan oleh perbandingan muatan kation dan anionnya.
Rumus : Ax+ + By+ → AyBx
Cara penulisan nama senyawa ion :
- Nama kation di depan dan nama anion di belakang, angka indeks tidak ditulis.
- Kation diberi nama sama dengan bagian logamnya. Jika logam memiliki bilangan oksidasi (biloks) bermacam-macam, maka biloks logam ditulis dengan angka romawi dalam tanda kurung.
- Anion monoatom atau poliatom tanpa unsur oksigen diberi nama akhiran “-ida”. Anion poliatom yang mengandung bagian oksigen diberi nama akhiran “-at” atau “-it” sesuai banyaknya jumlah atom O, kecuali pada anion OH–.
Berikut ini beberapa macam kation dan anion.
| Rumus Kation | Nama Kation | Rumus Anion | Nama Anion |
| Na+ | Natrium | OH– | Hidroksida |
| Mg2+ | Magnesium | Cl– | Klorida |
| Fe2+ | Besi(II) | NO3– | Nitrat |
| Cu+ | Tembaga(I) | SO42- | Sulfat |
| NH4+ | Amonium | CrO42- | Kromat |
Contoh :
- NaOH = natrium hidroksda
- KNO3 = kalium nitrat
- FeCl2 = besi(II) klorida
- K2CrO4 = kalium kromat
2. Senyawa Molekul
Senyawa molekul berisikan unsur-unsur non logam. Pada bagian ini hanya akan dibahas cara penamaan dari senyawa molekul biner (senyawa molekul yang mengandung dua jenis komponen).
Ada 2 cara penulisan nama senyawa molekul, adalah :
Cara 1
- Unsur yang terletak lebih kiri pada metode periodik unsur ditulis di depan. Kecuali pada senyawa yang mengandung oksigen dan halogen (kecuali fluorin), maka oksigen ditulis di belakang. Jika unsur-unsurnya terletak dalam satu kalangan, maka yang letaknya lebih bawah ditulis di depan.
- Menentukan biloks bagian yang berada di depan kemudian nilai biloks ditulis dengan angka romawi dalam tanda kurung. Unsur yang berada di belakang diberi nama akhiran “-ida”.
Contoh :
- N2O5 = nitrogen(IV) oksida
- SO3 = welirang(VI) oksida
Cara 2
- Unsur yang terletak lebih kiri pada tata cara periodik unsur ditulis di depan. Kecuali pada senyawa yang mengandung oksigen dan halogen (kecuali fluorin), maka oksigen ditulis di belakang. Jika unsur-unsurnya terletak dalam satu golongan, maka yang letaknya lebih bawah ditulis di depan.
- Menyebutkan jumlah komponen dengan bahasa latin (mono, di, tri, tetra, dst.). Namun bila bagian yang berada di depan hanya 1, tidak perlu ditulis “mono-“. Unsur yang berada di belakang diberi nama akhiran “-ida”.
Contoh :
- N2O5 = dinitrogen pentaoksida
- SO3 = belerang trioksida
3. Asam
Asam adalah senyawa yang mengandung ion H+ dan anion. Cara penulisannya yaitu dengan menulis kata “asam” dan disertai nama anion.
Contoh :
- HCl = asam klorida
- HF = asam fluorida
- H3PO4 = asam fosfat
Baca juga Reaksi Kimia.
Contoh Soal Tata Nama Senyawa
1. Secara sistematik, tuliskan nama dari senyawa-senyawa berikut.
- a. Ca3(PO)4
- b. Fe(NO3)2
- c. K2Cr2O7
- d. H2SO4
- e. N2O3
a. Ca3(PO)4 = kalsium fosfat
Karena terdiri dari kation Ca2+ dan anion PO43-, maka tergolong dalam senyawa ion.
b. Fe(NO3)2 = besi(II) nitrat
Karena berisikan kation Fe2+ dan anion NO3–, maka termasuk dalam senyawa ion.
c. K2Cr2O7 = kalium dikromat
Karena terdiri dari kation K+ dan anion Cr2O72-, maka tergolong dalam senyawa ion.
d. H2SO4 = asam sulfat
Karena mengandung ion H+ dan anion SO42-, maka tergolong dalam asam.
e. N2O3 = nitrogen(III) oksida = dinitrogen trioksida
Karena terdiri dari komponen-komponen non logam, maka tergolong dalam senyawa molekul.
2. Tuliskan rumus kimia dari nama-nama senyawa berikut.
- a. Difosfor pentaoksida
- b. Sulfur(IV) oksida
- c. Kalsium klorat
- d. Timah(IV) klorida
- e. Asam karbonat
- a. P2O5 (senyawa molekul)
- b. SO2 (senyawa molekul)
- c. Ca(ClO3) (senyawa ion)
- d. SnCl4 (senyawa ion)
- e. H2CO3 (asam)
Demikian pembahasan mengenai tata nama senyawa. Semoga dapat berguna. Baca juga Perkembangan Teori Atom.