PEMAHAMAN TERMODINAMIKA
Oleh : Tasya Ariibah (@W24-TASYA)
Pendahuluan
Termodinamika merupakan salah satu alat konseptual yang berkhasiat dalam memahami sains titik paradigma utama termodinamika ialah kesemestaan aturan-hukumnya melalui Hukum Termodinamika mampu dikenali bahwa sebuah proses kimia akan terjadi atau tidak mungkin terjadi pada keadaan tertentu sehingga mampu mengurangi banyak waktu dan ongkos.
Termodinamika banyak menggunakan istilah-ungkapan yang telah didefinisikan secara seksama dan telah dikukuhkan oleh semua penduduk ilmiah mirip metode, lingkungan, fungsi keadaan, dan beberapa ungkapan makroskopis yang lain
Termodinamika dan Bentuk – bentuk Energi
Termodinamika aturan kekekalan energi yang ialah besaran atau properti dari termodinamika, yang memiliki kualitas dan kuantitas, dan sebuah proses berjalan pada arah yang kualitasnnya menyusut.
a. Kerja (w)
Menurut konsep mekanika, kerja yaitu hasil perkalian antara gaya luar yang melakukan pekerjaan pada benda dengan jarak yang ditempuh oleh benda ketika gaya itu dipraktekkan. Jika benda bergerak lurus dari titik s1 ke titik s2 dengan gaya P yang diterapkan konstan sepanjang jalan itu, maka kerja yang dikerjakan pada benda yakni:
w = F ∆s
b. Kalor dan Energi lntemal
Kalor ialah cara perpindahan energi panas dari satu tata cara ke tata cara lain atau ke lingkungan .Oleh alasannya adalah energi internal tata cara dapat diubah dengan cara menerapkan kerja terhadap tata cara, maka pergantian energi internal dapat ditentukan dari kerja yang dijalankan terhadap metode yang dijalankan secara adiabat (metode adiabat). Hubungan antara kerja dan perubahan energi internal metode dalam proses adiabat diungkapkan dengan persamaan:
∆U= w
Perubahan energi internal metode dengan cara mengalirkan panas ke dalam metode tanpa ada perlakuan kerja dinyatakan dengan persamaan:
∆U = q
kalor yang diserap oleh sistem tertutup tanpa perlakuan kerja sama dengan pertambahan energi internal sistem.Sebaliknya, bila sistem melepaskan sejumlah kalor maka energi internal tata cara akan turun.
Hukum Pertama Termodinamika
Untuk banyak proses, baik kalor maupun kerja keduanya mampu menembus batas-batas metode. Perubahan energi yang terjadi ialah jumlah dari dua donasi ini. Secara biasa , energi yang ditransfer dari sistem ke lingkungan atau sebaliknya akan bermetamorfosis bentuk lain. Dengan kata lain, energi tidak dapat diciptakan ataupun dimusnahkan tetapi berganti bentuk. Pernyataan ini diketahui dengan Hukum pertama termodinamika (HPT). Persamaannya:
∆U = q + w
a. Perubahan Energi Internal Sistem, ∆U
Jika reaksi kimia yakni metode gas yang berjalan pada kondisi patokan dan sistem melaksanakan kerja lewat perubahan tekanan-volume.
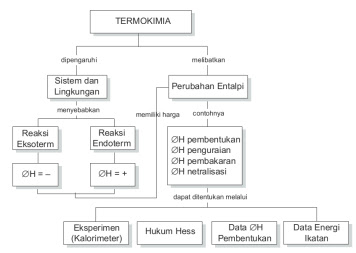
b. Perubahan Entalpi, ∆H
Pada volume tetap, besarnya kalor yang menyertai reaksi kimia sama dengan pergantian energi internal sistem (∆U = qv). Untuk mengenali keterlibatan kalor dalam reaksi kimia yang dijalankan pada tekanan tetap, diperkenalkan fungsi kondisi baru dinamakan entalpi, yakni:
H = U + PV
H dinamakan entalpi (berasal dari karakter permulaan kata Heat of Content). Entalpi merupakan fungsi kondisi yang harganya bergantung pada U, P, dan V. Perubahan entalpi sistem diungkapkan sebagai :
∆H = ∆U + ∆(PV)
Jika persamaan tersebut diterapkan pada tekanan tetap maka akan diperoleh persamaan
∆H = (q-P∆V) + P∆V
∆H =qp
Untuk reaksi yang melibatkan cairan atau padatan, pergeseran volume yang terjadi sangat kecil, karena kerapatan zat yang terkondensasi sangat tinggi. Apalagi kalau reaksi dijalankan pada tekanan rendah, contohnya 1 atm, maka ∆(PV) relatif sungguh kecil dan mampu diabaikan sehingga
∆H = ∆U
Jika gas dikonsumsi atau dihasilkan selama reaksi berlangsung, ∆H dan ∆U mampu mempunyai nilai sangat berlainan. Untuk gas ideal yang berjalan pada suhu tetap, maka
∆(PV)= ∆nRT;
dengan ∆n yakni perubahan mol gas selama reaksi berlangsung. Dengan demikian, dari persamaan diatas untuk tata cara gas yang berlangsung pada suhu tetap diperoleh kekerabatan:
∆H = ∆U + ∆nRT
Sistem Tertutup dan Terbuka
Sistem Tertutup : Dinamakan kontrol kurun, pada metode ini tidak terjadi pertukaran periode antara sistem dan lingkungan, namun cuma terjadi pertukaran energi.
Sistem Terbuka : Dinamakan kendali volume pada tata cara ini dapat terjadi pertukaran masa dan energi antara sistem dan lingkungan.
Sistem Terisolasi : Ketika tidak terjadi pertukaran antara dua hal tersebut
Kajian Termodinamika
Hukum Ke-nol Termodinamika
Terdapat dua benda yang setimbang termal dengan benda ke tiga.
Konsep tempratur dan alat ukur suhu: 2 benda dalam keaddan setimbang termal jika kedua benda mempunyai temperatur yang sama.
Termokimia dalam kehidupan sehari-hari
Gas Elpiji
Penggunaan gas elpiji yang menjadi bagian daripada arti gas alam menjadi hal yang intensitasnya sering dipakai. Gas elpiji yang dipakai pada kompor gas utamanya menggunakan reaksi antara butana dengan udara.
Dalam aplikasinya udara sepenuhnya bergantung pada oksigen. Namun reaksi termokimia pada gas elpiji dapat melibatkan bentuk yang tidak tepat, misalnya membutuhkan 200% udara. Selain itu pembakaran pada kompor juga melibatkan beberapa fraksi, karena elpiji tidak murni pada hanya bahan bakar butana.
Termometer
Termometer yakni salah satu alat laboratorium kimia yang terkenal dipakai untuk mengukur suhu badan atau suhu objek tertentu. Dalam mengukur suhu, termometer bekerja dengan prosedur dikala suhu naik, cairan pada bola tabung akan mengembang lebih banyak ketimbang gelas yang menutupinya.
Dari peristiwa tersebut menciptakan benang cairan yang tipis haris bergerak ke atas secara kapiler. Sebaliknya, saat temperatur turun, cairan akan mengerut dan cairan tipis pada tabung bergerak kembali turun. Gerakan yang terjadi pada ujung cairan tipis dinamakan meniscus yang dibaca pada skala penunjuk temperatur.
Zat yang digunakan untuk termometer mesti berasal dari zat cair dengan sifat termometrik atau dapat mengalami pergeseran fisis ketika dipanaskan atau ketika didinginkan. Beberapa bahan yang umumnya digunakan ialah raksa dan alkohol.
Kedua zat tersebut memiliki dua titik tetap, yaitu titik tertinggi dan paling rendah. Contohnya titik didih air dan titik lebur es pada suhu yang tidak terlalu tinggi. kemudian, dilakukan pembagian antara kedua titik tersebut dengan sama besar, contohnya termometer dengan skala celcius dengan 100 bagian, maka setiap bagian nilainya sebesar 1 C.
Pembakaran Batu Bara
Dalam kehidupan sehari-hari definisi batubara banyak dimanfaatkan untuk sumber materi bakar, dalam skala kecil digunakan pada rumah tangga dan dalam skala besar digunakan pada industri. Mis
alnya industri PLTU memakai materi batubara selaku pencetus turbin dan dapat menciptakan sumber energi arus listrik.
Selain selaku aktivis turbin, batubara juga mampu dimanfaatkan untuk bahan kecantikan dan juga compact disk (CD). Batubara memiliki kekurangan sebab akan menciptakan gas SO2, tetapi untuk menghilangkannya mampu dipraktekkan proses desulfurisasi. Proses desulfurisasi memakai serbuk kapur atau spray air kapur di dalam alat scrubers.
Akan namun ongkos operasional dari proses desulfurisasi serta pembuangan deposit padatan akan menjadi dilema yang baru. Maka untuk mengembangkan nilai batubara dan menghilangkan pencemarnya mampu dilakukan rekayasa batubara, contohnya gasifikasi dan juga reaksi karbon uap.
Pada gasifikasi molekul batubara yang berukuran besar dipecah dengan pemanasan dengan suhu yang tinggi sekitar 600 hingga dengan 800 celcius. Hasilnya adalah materi bakar yang berbentukgas.
Kesimpulan
Kesimpulan yang dapat ditarik penulis dari hasil membaca dan mempelajari Termodinamika secara singkat. Yang mampu diterapkan dalam lingkungan kerja dan selaku penambahan pembelajaran bagi para mahasiswa. Termodinamika juga dapat di temui dalam kehidupan sehari hari yang memungkinkan individu dapat berfikir luas.
Daftar Pustaka
https://www.pakarkimia.com/termokimia-dalam-kehidupan-sehari-hari/
https://www.youtube.com/watch?v=g51j1GGCGDE&t=2s
Modul 2 TERMODINAMIKA