Bilangan Oksidasi : Pengertian, Aturan Penentuan & Contoh Soalnya – Apa itu bilangan oksidasi dan contohnya? Pada kesempatan ini Seputarpengetahuan.co.id akan membahasnya dan pastinya perihal hal lain yang juga melingkupinya.
Mari kita simak bareng pembahasannya pada postingan di bawah ini untuk lebih dapat memahaminya
Daftar Isi
Bilangan Oksidasi : Pengertian, Aturan Penentuan & Contoh Soalnya
Bilangan oksidasi atau Biloks yakni jumlah muatan negatif dan positif dalam atom, yang secara tidak langsung menunjukkan jumlah elektron yang telah diterima atau diserahkan ke atom lain. Beberapa atom hanya memiliki satu biloks, tetapi ada beberapa atom yang mempunyai lebih dari satu biloks.
Jika kamu memperoleh nilai dari sebuah bilangan atom pada sebuah molekul ataupun senyawa, maka kamu harus mengetahui apalagi dahulu biloks atom unsur lainnya yang mempunyai sifat umum (patokan).
Aturan Menentukan Biloks
Untuk menentukan bilangan oksidasi (Biloks) pada suatu ion atau senyawanya yang lain harus mengikuti hukum-hukum dibawah ini:
-
Biloks unsur bebas yang berupa atom atau molekul komponen yang bernilai 0 (nol).
Unsur bebas yang berbentuk atom adalah:
-
- Biloks C pada C bernilai = 0
- Biloks Ca pada Ca bernilai = 0
- Biloks Cu pada Cu bernilai = 0
- Biloks Na pada Na bernilai = 0
- Biloks Fe pada Fe bernilai = 0
- Biloks Al pada Al bernilai = 0
- Biloks Ne dalam Ne bernilai = 0
Unsur bebas yang berbentuk molekul adalah:
-
- Biloks H pada H2 bernilai = 0
- Biloks O pada O2 bernilai = 0
- Biloks Cl dalam Cl2 bernilai = 0
- Biloks P dalam P4 bernilai = 0
- Biloks S dalam S8 bernilai = 0
-
Biloks berupa logam dalam senyawa selalu bernilai nyata.
Pada komponen logam golongan 1 (sistem usang gol. IA) (Li, Na, K, Rb, Cs, Fr), Biloksnya yaitu +1.
-
- Biloks K dalam KCl, KNO3, atau K2SO4 bernilai = +1
Pada nsur logam golongan 2 (sistem usang golongan. IIA) (Be, Mg, Ca, Sr, Ba, Ra), Biloksnya ialah +2.
-
- Biloks Mg dalam MgO, MgCl2, atau MgSO4 bernilai = +2
Bilangan oksidasi (Biloks) bagian logam lainnya yakni:
-
- Ag bernilai = +1
- Cu bernilai = +1 dan +2
- Hg bernilai = +1 dan +2
- Au bernilai = +1 dan +3
- Fe bernilai = +2 dan +3
-
Bilangan oksidasi (Biloks) ion monoatom (untuk 1 atom) dan poliatom (lebih dari 1 atom) yaitu sama pada muatan ionnya.
-
-
Biloks ion monoatom ialah Na+, Ca2+, Al3+, Cl–, dan 02- berurutan +1,+2, +3, -1 dan -2.
- Biloks ion poliatom yaitu NH4+, SO42-, PO43- berurutan +1,-2, dan -3.
-
-
Bilangan oksidasi (Biloks) komponen kalangan VIA (O, S, Se, Te, Po) dalam senyawa biner yakni -2, dan unsur kelompok VIIA (F, Cl, Br, I, At) dalam senyawa biner ialah -1.
-
-
Biloks bagian S dalam Na2S dan MgS bernilai = -2.
- Biloks komponen Cl dalam NaCl, KCl, MgCl2, dan FeCl3 bernilai = -1.
-
-
Bilangan oksidasi (Biloks) bagian H dalam senyawanya bernilai = +1.
Kecuali pada Biloks hidrida (senyawa hydrogen dengan logam) bernilai = -1.
Dikarenakan pada senyawa hidrida, hidrogen ada pada bentuk ion hidrida, H–. Biloks ion mirip hidrida ialah sama mirip muatan ion, yang bernilai = -1.
-
- Biloks bagian H dalam H2O, HCl, H2S, dan NH3 bernilai = +1.
- Biloks bagian H dalam NaH, CaH2, dan AlH3 bernilai = -1.
-
Bilangan oksidasi (Biloks)bagian O dalam senyawanya bernilai = -2, kecuali,
-
-
Biloks senyawa biner dalam F, bernilai = +2.
- Biloks senyawa peroksida, seperti H2O2, Na2O2 dan BaO2 , bernilai = -1.
- Biloks senyawa superoksida, seperti KO2 dan NaO2, bernilai = -½ .
- Bilangan oksidasi (Biloks) unsur O dalam H2O, KOH, H2SO4 dan Na3PO4 bernilai = -2
-
-
Jumlah pada bilangan oksidasi (Biloks) komponen-komponen pada senyawa ialah 0 (nol).
Jumlah pada suatu bilangan oksidasi bagian-unsur pembentuk ion atau senyawa poliatom yaitu sama dengan muatan ion poliatomnya itu sendiri.
-
Bilangan oksidasi oksigen (O) dalam senyawa proksida = -1. Bilangan oksidasi O dalam senyawa non-peroksida = -2.
Contoh:
Biloks O dalam BaO2 = -1.
Atom Ba merupakan komponen logam golongan IIA, sehingga biloks Ba = +2. Jumlah biloks Ba dan biloks O harus 0 (hukum biloks poin 6). Oleh alasannya itu, biloks O mesti bernilai -2. Karena atom O mempunyai indeks 2, jadi biloks O : indeks O = -2 : 2 = -1. Terbukti jikalau biloks O dalam BaO2 ialah -1.
Contoh Soal Bilangan Oksidasi
Contoh Soal 1
Tentukan bilangan oksidasi atom bagian yang dicetak tebal pada senyawa dibawah ini:
- N2O5
- MnO4–
- Al2(SO4)3
Jawab:
Biloks akan diputuskan, misalnya x:
- 1. Muatan N2O5 adalah (2 x biloks N) + (5 x biloks O)
0 = (2x (x)) + (5 x (-2))
0 = 2x – 10
x = +5
Kaprikornus, bilangan oksidasi atom N pada senyawa N2O5 yakni +5
- 2.Muatan MnO4– yaitu (1 x biloks Mn) + (4 x biloks O) sebagai berikut!
-1 yakni (1 x (x)) + (4 x (-2))
-1 ialah x – 8
x adalah +7
Makara, biloks atom Mn pada senyawa MnO4– ialah +7
- 3. Muatan Al2(SO4)3 = (2 x biloks Al) + (3 x biloks S) + (12 x biloks O), adalah:
0 = (2 x (+3)) + (3 x (x)) + (12 x (-2))
0 = 6 + 3x -24
x = +6
Kaprikornus, bilangan oksidasi atom S pada senyawa Al2(SO4)3 yakni +6.
Contoh Soal 2
Langsung saja untuk Contol Soal didalam Bilangan Oksidasi, bahwa didalam ‘ Berapakan nilai Biloks dari Atom C didalam Bilangan Oksidasi pada CH4 dengan Aturan Bilangan Oksidasi Biloks H = +1 ?
Jawaban :
Biloks H x Jumlah Atom H = + ‘1 x 4 = +4
Biloks C x Jumlah Atom C = a x 1 = a
Jika dilihat dari Senyawa tersebut adalah Senyawa Netral, maka Jumlah Biloks dari Unsur Unsur didalamnya haruslah NOl, mempunyai arti :
a + (+4) = O
a = -4
Makara Bilangan Oksidasi C pada Senyawa CH4 adalah -4.
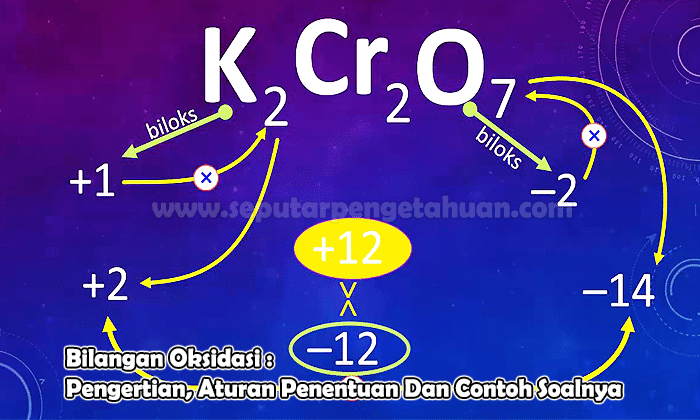
Contoh Soal 3
Tentukan bilangan oksidasi atom unsur N pada senyawa dibawah ini:
N2O5
Jawab:
Biloks akan ditandai dengan X
Muatan N2O5 yakni (2 x biloks N) + (5 x biloks O)
0 = (2 x (x)) + (5 x (-2))
0 = 2x – 10
x = +5
Makara, bilangan oksidasi atom N pada senyawa N2O5 adalah +5.
Demikianlah ulasan dari Seputarpengetahuan.co.id tentang Bilangan Oksidasi : Pengertian, Aturan Penentuan & Contoh Soalnya, supaya dapat menambah pengetahuan dan pengetahuan kalian. Terimakasih sudah berkunjung dan jangan lupa untuk membaca artikel yang lain.