Sering kali kita menemui bahan-materi tertulis kadarnya. Contohnya pada cuka tertulis kadarnya 50%. Sedangkan di laboratorium, bahan kimia memakai satuan konsentrasi molaritas. Baik persentase maupun molaritas menunjukkan kadar atau konsentrasi zat tersebut dalam larutan.
Bagaimana penentuan konsentrasi masing-masing larutan itu?
Pada potensi kali ini kita akan membicarakan salah satu sistem penentuan konsentrasi sebuah zat, yakni Titrasi Asam Basa.
Daftar Isi
Pengertian Titrasi Asam Basa
Titrasi ialah sistem analisis kuantitatif untuk menentukan fokus/kadar suatu analit (senyawa yang dianalisis) dalam sampel. Reagen yang dipakai untuk menitrasi disebut titran.
Sedangkan larutan yang dititrasi disebut titrat. Titrat pada volume tertentu direaksikan dengan titran yang sudah dimengerti konsentrasinya tetes demi tetes sampai terjadi pergeseran yang membuktikan titik ekuivalen.
Titrasi asam basa dapat diartikan sebagai penentuan konsentrasi asam dalam larutan dengan cara menitrasinya dengan larutan basa yang sudah diketahui konsentrasinya, atau sebaliknya.
Pada titrasi terjadi pergeseran pH, misalkan pada titrasi asam berpengaruh oleh basa berpengaruh, maka pH akan meningkat sedikit demi sedikit sampai mendekati titik ekuivalen, kemudian meningkat secara signifikan dan kembali berkembangsecara perlahan sesudah melalui titik ekuivalen.
Perubahan tersebut digambarkan pada kurva titrasi asam basa.
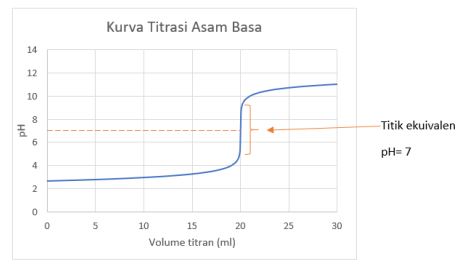
Titik tengah dari garis signifikan tersebut ialah titik ekuivalen, dimana titrat bereaksi sempurna dengan titran. Pada aplikasinya dipakai indikator untuk membuat lebih mudah penentuan titik ekuivalen adalah ditandai dengan berubahnya warna indikator.
Beberapa indikator yang digunakan sebagai berikut.
| Indikator | Perubahan WarnaPada Asam | Rentang pH | Perubahan WarnaPada Basa |
| Bromofenol Biru | Kuning | 3.0-4.6 | Biru |
| Metil Jingga | Merah | 3.1-4.4 | Kuning |
| Metil Merah | Merah | 4.4-6.3 | Kuning |
| Fenolftalein (PP) | Tidak Berwarna | 8.3-10.0 | Merah Muda |
| Alizarin Kuning | Kuning | 10.1-12.0 | Merah |
Seperti apa sih penerapan titrasi asam basa dalam kehidupan sehari-hari? Mari kita bahas lebih lanjut.
Penerapan titrasi asam basa pada kehidupan sehari-hari
Berbagai materi sehari-hari yang kita temui lewat tahap penentuan kadar yang salah satunya menggunakan metode titrasi. Cuka yang sering digunakan untuk embel-embel makan merupakan salah satu acuan larutan asam dengan nama senyawa asam asetat.
Penentuan kadar asam asetat yang ialah asam lemah dijalankan dengan titrasi memakai basa besar lengan berkuasa seperti natrium hidroksida (NaOH) atau basa lemah seperti natrium tetraborat (Na2[B4O5(OH)4]·8H2O) dengan indikator titrasi yang sesuai. Titrasi dikerjakan pula pada aneka macam produk yang sering kita jumpai, antara lain:
- Penentuan kadar asam fosfat (H3PO4) dalam pupuk
- Penentuan kadar asam hipoklorit (HClO) dalam pemutih busana
- Penentuan kadar asam benzoat (C6H5COOH) dalam desinfektan
- Penentuan kadar asam format (HCOOH) dalam formalin yang dipakai pada industri tekstil
Penentuan kadar zat-zat tersebut pastinya melalui perhitungan hasil titrasi. Untuk lebih jelasnya, mari simak pembahasan selanjutnya.
Menghitung fokus sampel dengan titrasi asam basa
Perhitungan pada titrasi asam basa didasarkan oleh terjadinya ekuivalen, dimana kedua zat baik asam maupun basa habis bereaksi. Contoh pada reaksi
HCl (aq) + NaOH (aq) à NaCl (aq) + H2O (l)
maka berlaku
1 mol HCl = 1 mol NaOH
MHCl x VHCl = MNaOH x VNaOH
Untuk reaksi dengan valensi yang berlawanan misal,
H2SO4 (aq) + 2 NaOH (aq) à Na2SO4 (aq) + 2 H2O (l)
maka rumusnya menjadi
2 mol H2SO4 = 1 mol NaOH
2 x MH2SO4 x VH2SO4 = MNaOH x VNaOH
Setelah dimengerti molaritas analit, kadarnya dapat ditentukan menggunakan rumus berikut ini.
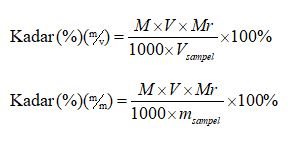
Bagaimana? Sudah paham kan? Langsung kita praktekkan ke Contoh Soal yuk!
Contoh Soal Titrasi Asam Basa
1. Sebanyak 20 ml sampel mengandung NaOH dititrasi dengan HCl 0,1 M. Volume titran yang dibutuhkan untuk meraih titik ekuivalen ialah sebanyak 18 ml. Berapakah konsentrasi NaOH dalam sampel tersebut?
Penyelesaian
Diketahui:
VNaOH = 20 ml
VHCl = 18 ml
MHCl = 0,1 M
Ditanya: MNaOH
Jawab:
MHCl x VHCl = MNaOH x VNaOH
0,1 M x 18 ml = MNaOH x 20 ml
MNaOH = 0,1 M x 18 ml / 20 ml
= 0,09 M
2. Pada sebuah pabrik pupuk dilaksanakan pengujian sampel. Kadar asam fosfat (H3PO4) dalam pupuk diatur tidak lebih dari 85%. Diketahui 0,5 gram sampel yang dilarutkan dalam 10 ml akuades kemudian dititrasi dengan NaOH 0,5 M tepat memerlukan 25 ml. Apakah sampel tersebut masuk ke dalam standar yang telah diputuskan? (Mr H3PO4 = 98)
Penyelesaian
Diketahui:
msampel = 0,5 gram
VH3PO4 = 10 ml
VNaOH = 25 ml
MNaOH = 0,5 M
Dintanya: kadar H 3PO4
Jawab
H3PO4 (aq) + 3 NaOH (aq) à Na3PO4 + 3 H2O
3 mol H3PO4 = 1 mol NaOH
3 x MH3PO4 x VH3PO4 = MNaOH x VNaOH
3 x MH3PO4 x 10 ml = 0,5 M x 25 ml
MH3PO4 = 0,5 M x 25 ml / (3 x 10 ml)
MH3PO4 = 0,4167 M
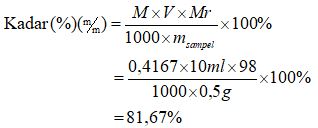
Makara, sampel tersebut tidak masuk ke dalam patokan yang sudah ditentukan alasannya adalah kurang dari 85%.
Kesimpulan
Titrasi merupakan tata cara analisis kuantitatif untuk memilih konsentrasi sebuah analit dalam sampel.
Titrasi asam basa dipakai untuk memilih konsentrasi sebuah asam dengan menitrasinya dengan basa yang telah dimengerti konsentrasinya, dan sebaliknya. Banyak sekali materi-bahan yang sehari-hari kita temui melalui analisis titrasi.
Demikian pembahasan tentang titrasi asam basa. Semoga berfaedah untuk kita semua. Baca juga Polimer.