Dalam bidang kajian kimia, stoikiometri yakni ilmu yang mempelajari hubungan kuantitatif zat-zat yang terlibat dalam reaksi kimia, baik reaktan maupun produk/hasil reaksi.
Dengan menggunakan asas-asas stoikiometri, kita dapat mengkalkulasikan massa atau volume reaktan yang diharapkan untuk menghasilkan sejumlah massa atau volume produk yang dikehendaki.
Pengetahuan wacana stoikiometri ini sungguh diperlukan dalam industri kimia karena selalu harus memperhitungkan banyaknya bahan baku yang diperlukan untuk menciptakan sejumlah produk tertentu.
Untuk lebih jelasnya, mari kita simak bahan stoikiometri berikut.
Daftar Isi
Materi Stoikiometri
Stoikiometri didasarkan pada aturan-hukum dasar kimia yang meliputi :
- Hukum kekekalan massa (Hukum Lavoisier)
- Hukum perbandingan tetap (Hukum Proust)
- Hukum perbandingan berganda (Hukum Dalton)
- Hukum perbandingan volume gas (Hukum Gay Lussac)
- Hukum Avogadro
Hukum Kekekalan Massa (Hukum Lavoisier)
Antoine Laurent Lavoisier ialah penggagas dari hukum kekekalan massa, yang menyimpulkan bahwa
“Dalam metode tertutup, massa zat sebelum dan setelah reaksi ialah sama”.
Misalnya, pada reaksi perkaratan besi (besi mengikat oksigen dari udara), dimana besi yang memiliki massa tertentu akan bereaksi dengan sejumlah oksigen membentuk senyawa besi oksida (Fe2O3(s)) yang massanya sama dengan massa besi dan oksigen mula-mula.
Fe(s) + O2(g) → Fe2O3(s)
Hukum Perbandingan Tetap (Hukum Proust)
Joseph Louis Proust ialah pencetus dari hukum perbandingan tetap. Berdasarkan hasil penelitiannya, disimpulkan bahwa
“Perbandingan massa unsur-komponen dalam satu senyawa yaitu tertentu dan tetap”.
Namun kalau perbandingan massa komponen tidak cocok, maka akan dihasilkan zat sisa. Senyawa yang serupa meskipun berasal dari kawasan yang berlawanan atau dibentuk dengan cara yang berlainan ternyata mempunyai komposisi yang serupa.
Misalnya, hasil analisis terhadap garam natrium klorida dari banyak sekali daerah selaku berikut.
| Asal | Massa Garam | Massa Natrium | Massa Klorida | Massa Na : Cl |
| Impor | 2,5 gram | 0,983 gram | 1,517 gram | 1 : 1,54 |
| Madura | 1,5 gram | 0,59 gram | 0,91 gram | 1 : 1,54 |
| Indramayu | 2 gram | 0,786 gram | 1,214 gram | 1 : 1,54 |
Dalam tabel di atas,ditunjukkan bahwa perbandingan massa Na kepada Cl ternyata tetap, yaitu 1 : 1,54.
Hukum Perbandingan Berganda (Hukum Dalton)
Berdasarkan hasil percobaannya, Dalton menyimpulkan bahwa
“Jika dua jenis komponen bergabung membentuk lebih dari satu senyawa, dan jika massa-massa salah satu unsur dalam senyawa-senyawa tersebut sama, sedangkan massa-massa komponen yang lain berbeda, maka perbandingan massa komponen lainnya dalam senyawa-senyawa tersebut ialah bilangan bundar dan sederhana.”
Misalnya, perbandingan nitrogen dan oksigen dalam senyawanya sbb. :
| Senyawa | Massa Nitrogen (gr) | Massa Oksigen (gr) | Perbandingan |
| N2O | 28 | 16 | 7 : 4 |
| NO | 14 | 16 | 7 : 8 |
| N2O3 | 28 | 48 | 7 : 12 |
| N2O4 | 28 | 64 | 7 : 16 |
Dari tabel tersebut, jika massa nitrogen dibentuk tetap (sama) sebanyak 7 gram, perbandingan massa oksigen dalam N2O, NO, N2O3, dan N2O4 = 4 : 8 : 12 : 16 atau 1 : 2 : 3 : 4.
Hukum Perbandingan Volume (Hukum Gay Lussac)
Hukum perbandingan volume dicetuskan oleh Gay Lussac yang berbunyi
“Perbandingan volume gas-gas sesuai dengan koefisien masing-masing gas”.
Untuk dua buah gas (
misal gas A dan gas B) yang tercantum dalam persamaan reaksi, berlaku relasi :
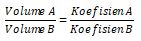
Hukum Avogadro
“Pada suhu dan tekanan yang serupa, semua gas dengan volume yang serupa akan mengandung jumlah molekul yang serupa pula”.
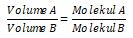
Selain hukum-aturan dasar kimia tersebut, dalam stoikiometri juga mempelajari wacana konsep mol yang terdiri atas kekerabatan mol dengan jumlah partikel, massa molar, volume molar gas, dan molaritas larutan.
Hubungan antara jumlah mol (n) dengan jumlah partikel (X) dalam zat dapat dinyatakan sbb. :
X = n x 6,02 x 1023
Jumlah partikel = mol x 6,02 x 1023
Massa molar (mm) menyatakan massa yang dimiliki oleh 1 mol zat. Massa 1 mol zat sama dengan massa molekul relatif (Mr) zat tersebut dengan satuan gram/mol.
Hubungan jumlah mol (n) dengan massa zat (m) adalah sbb. :
m = n x mm atau massa = n x Ar atau massa = n x Mr
Volume molar gas menyatakan volume per mol gas. Berdasarkan pengukuran kerapatan gas-gas pada suhu dan tekanan tertentu ditemukan bahwa rata-rata volume molar sebuah gas pada keadaan patokan (suhu 0⁰ C dan tekanan 1 atm) atau dalam kondisi STP (Standard Temperature and Pressure, artinya pada suhu dan tekanan standar) adalah 22,4 liter.
Dari pengukuran tersebut, maka mampu dirumuskan volume gas pada kondisi standar sbb. :
V = n x 22,4 liter
Pada kondisi yang bukan persyaratan atau suhu 0⁰ C dan tekanan 1 atm (STP), maka volume gas mampu dijumlah dengan persamaan gas ideal :
PV = nRT
dimana :
- P = tekanan gas (atm)
- V = volume gas (liter)
- n = jumlah mol gas
- R = tetapan gas (0,082 L atm/mol K)
- T = suhu mutlak gas (K)
Molaritas (M) menyatakan jumlah mol zat terlarut dalam tiap liter larutan. Satuan molaritas (M) adalah mol/liter atau mmol/mL.
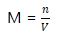
dimana :
- M = molaritas (mol/liter atau M)
- n = jumlah mol zat terlarut (mol)
- V = volume larutan (liter)
Sudah paham kan? Jika belum, mari kita bahas contoh soal stoikiometri biar lebih paham perihal penerapan bahan stoikiometri. Baca juga Polimer.
Contoh Soal Stoikiometri
1. Perbandingan massa bagian hidrogen dan oksigen yang menyusun air (H2O) senantiasa sama, adalah 1:8. Tentukan massa air yang terbentuk dari :
- 1 gram hidrogen + 8 gram oksigen
- 2 gram hidrogen + 8 gram oksigen
- 1 gr hidrogen: 8 gr oksigen = 1 : 8. Massa air yang terbentuk sebanyak 9 gram dan tidak ada zat sisa.
- 2 gr hidrogen : 8 gr oksigen. Supaya perbandingan dapat sesuai, maka tidak semua reaktan akan membentuk air. Dalam hal ini cuma 1 gram hidrogen yang bereaksi dengan 8 gram oksigen, sedangkan 1 gram hidrogen lainnya akan menjadi zat sisa. Jadi massa air yang terbentuk sebanyak 9 gram dan terbentuk zat sisa, yakni 1 gram hidrogen.
2. Untuk pembentukan uap air disediakan 6 liter gas H2. Tentukan volume gas oksigen yang dibutuhkan dan volume uap air yang terbentuk.
2H2 + O2 → 2H2O (g)
Volume O2 yang diharapkan = ![]() x volume H2 = x 6 liter = 3 liter
x volume H2 = x 6 liter = 3 liter
Volume H2O yang terbentuk = ![]() x volume H2 = x 6 liter = 6 liter
x volume H2 = x 6 liter = 6 liter
3. Berapakah volume dari 10 gram CO2 jika diukur pada keadaan STP? (Ar C = 12, Ar O = 16)
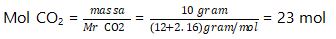
V. CO2 (STP) = mol x 22,4 liter = 0,23 x 22,4 liter = 5,152 liter
Makara, gas CO2 dalam kondisi STP yang terbentuk sebanyak 5,152 liter.
Demikian sedikit pembahasan perihal stoikiometri. Semoga berguna bagi anda yang sedang mempelajarinya. Baca juga Titrasi Asam Basa.