Reaksi redoks (oksidasi-reduksi) merupakan proses-proses elektrokimia, dimana reaksinya melibatkan korelasi antara listrik dan reaksi kimia.
Ingin tahu lebih lanjut perihal reaksi redoks? Mari kita bahas bareng bagian berikut ini.
Daftar Isi
Pengertian Reaksi Redoks
Reaksi redoks reaksi kimia yang terdiri dari setengah reaksi oksidasi dan setengah reaksi reduksi yang dibarengi dengan adanya perubahan bilangan oksidasi (biloks) baik pada reaktan maupun produk.
Reaksi oksidasi ditandai dengan adanya pengikatan oksigen, pelepasan elektron, atau peningkatan biloks.
Sedangkan reaksi reduksi ditandai dengan adanya pelepasan oksien, penangkapan elektron, atau penurunan biloks.
Unsur atau senyawa yang mengalami oksidasi disebut reduktor, sedangkan bagian atau senyawa yang mengalami reduksi disebut oksidator.
Berikut ini yakni nilai biloks dari :
- Unsur bebas (misal O2, Al, dan Fe) = 0
- Unsur H dalam senyawa = +1; kecuali dalam hidrida = -1
- Unsur O dalam senyawa = -2; kecuali dalam peroksida = -1, dan dalam oksifluorida = +2
- Unsur logam dalam senyawa = jumlah elektron valensi (+)
- Unsur non logam dalam senyawa biner = gol. VI A (biloks = -2); gol. VII A (biloks = -1)
- Biloks total dalam senyawa = 0
- Biloks dari ion tunggal maupun ion poliatomik = jumlah muatan
Dalam reaksi redoks, terdapat senyawa yang mengalami reaksi oksidasi sekaligus reduksi sehingga reaksi itu disebut reaksi autoredoks (disproporsionasi).
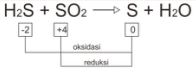
Ada juga reaksi redoks dimana hasil oksidasi sama dengan hasil reduksi, sehingga reaksi itu disebut reaksi konproporsionasi.
Contoh reaksi autoredoks (disproporsionasi)
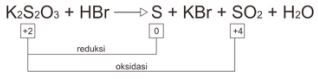
Contoh reaksi konproporsionasi
Baca juga Hidrolisis.
Penyetaraan Reaksi Redoks
Dalam reaksi redoks perlu dilaksanakan penyetaraan jumlah atom dan jumlah muatan pada reaktan dan produk.
Terdapat dua cara untuk menyetarakannya, ialah dengan cara bilangan oksidasi dan cara setengah reaksi.
Bilangan Oksidasi
Langkah-langkah :
- Menandai komponen yang mengalami pergantian biloks, disamakan jumlah atomnya.
- Menentukan biloks komponen yang berubah, dijumlah pergeseran dan disamakan jumlahnya.
- Menyetarakan kation, anion, hidrogen, dan oksigen (bila ada).
- Menyamakan muatan. Apabila reaksi asam, maka ditambah H+ dan disetarakan dengan H2O; kalau reaksi basa, maka ditambah OH– dan disetarakan dengan H2O.
Setengah Reaksi
Langkah-langkah :
- Menuliskan ion-ion yang mengalami oksidasi dan reduksi secara terpisah.
- Menyamakan jumlah atom-atom yang mengalami perubahan biloks.
- Selisih biloks dikali jumlah atom = jumlah elektron.
- Jumlah elektron ditulis di kiri bila reaksi reduksi, sedangkan ditulis di kanan bila reaksi oksidasi.
- Jumlah elektron di kiri dan kanan disetarakan.
- Jumlah muatan di kiri dan kanan disetarakan dengan penambahan H+ (situasi asam) dan atau OH– (situasi basa).
- Menyetarakan jumlah atom dengan menyertakan H2O.
Baca juga Laju Reaksi.
Contoh Soal Reaksi Redoks
1. Tentukan biloks dari masing-masing bagian dalam senyawa berikut.
- SO42-
- NaNO3
SO42– = ion poliatomik
Biloks dari ion poliatomik = jumlah muatan = -2
Biloks O dalam senyawa = -2
Biloks S + 4 . biloks O = -2
-6+ 4 . (-2)= -2
Kaprikornus, biloks S = -6 dan biloks O = -2.
NaNO3 = senyawa tak bermuatan
Biloks total = 0
Biloks O dalam senyawa = -2
Biloks Na (logam) = jumlah elektron valensi = +1
Biloks Na + bilok
s N + 3 . biloks O = 0
+1 + (+5) + 3 . (-2) = 0
Jadi, biloks Na = +1, biloks N = +5, dan biloks O =-2
Baca juga Termokimia.
2. Tentukan unsur atau senyawa yang manakah yang ialah oksidator, reduktor, hasil oksidasi, dan hasil reduksi dari reaksi kimia berikut ini.
Fe + HCl → FeCl3 + H2
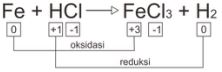
Oksidator (mengalami reduksi) = HCl
Reduktor (mengalami oksidasi) = Fe
Hasil oksidasi = FeCl3
Hasil reduksi = H2
3. Setarakan persamaan reaksi redoks berikut dengan cara bilangan oksidasi dan cara setengah reaksi.
Bi2O3 + ClO– → 2BiO3– + Cl– (suasana basa).
Cara Bilangan Oksidasi

- Disamakan muatan kiri dan kanan : 2OH– + Bi2O3 + ClO– → 2BiO3– + Cl–
- Disamakan jumlah atom-atomnya : 2OH– + Bi2O3 + 2ClO– → 2BiO3– + 2Cl– + H2O
Reaksi Setara : 2OH– + Bi2O3 + 2ClO– → 2BiO3– + 2Cl– + H2O
Cara Setengah Reaksi
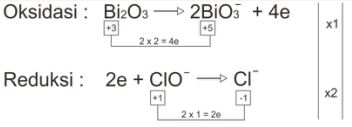
Redoks : Bi2O3 + 2ClO– → 2BiO3– + 2Cl–
- Setarakan muatan dengan menambahkan OH– (basa).
2OH– + Bi2O3 + 2ClO– → 2BiO3– + 2Cl–
- Setarakan jumlah atom dengan menambahkan H2O.
2OH– + Bi2O3 + 2ClO– → 2BiO3– + 2Cl– + H2O
Reaksi Setara : 2OH– + Bi2O3 + 2ClO– → 2BiO3– + 2Cl– + H2O
Demikian pembahasan perihal reaksi redoks (oksidasi-reduksi). Semoga mampu berfaedah. Baca juga Ikatan Kimia.