Oleh : Debi kurniawan ( @W05-DEBI )
Abstrak :
Termodinamika ialah suatu alat yang sangat penting dalam memahami kestimbangan kimia yang terjadi baik secara alami maupun secara bikinan. Energi bebas Gibbs merupakan salah satu parameter dalam termodinamika yang menyatakan apakah kelangsungan suatu reaksi akan terjadi secara spontan atau tidak. Komposisi setimbang reaksi ditentukan oleh ∆G° dan K. Nilai G akan berganti seiring dengan pergeseran komposisi kimia reaktan menjadi produk. Kesetimbangan kimia untuk melihat kekerabatan antara tetapan kesetimbangan kimia dengan konversi jikalau suhu dinaikan. Parameter kinetika menjadi sebuah konstanta kesetimbangan kimia (K) yang diperoleh dengan cara mengolah data penelitian, berupa pergantian bilangan iodin pada tiap waktu dan suhu.
Kata Kunci : Persamaan Reaksi, Tetapan, Kesetimbagan Kimia
Kesetimbangan kimia ialah keadaan dimana ketika kedua reaktan dan produk hadir dalam satu konsentrasi yang tidak memiliki kecenderungan lebih lanjut untuk berganti seiring berjalannya waktu. Konsep kesetimbangan ialah dasar dalam ilmu kimia, yang dalam kenyataannya reaksi kimia bersifat reversibel, dalam sisem tertutup, pada keadaan simpulan akan didapatkan kesetimbangan antara reaktan dan produk. Hingga bukan tidak mungkin gangguan eksternal juga akan menghipnotis proses kesetimbangan.
Reaksi Kesetimbangan Kimia (Sumber: Universitas Indonesia)
Dengan Persamaan Reaksi Kesetimbangan : N₂O₄(g) = 2NO₂(g).
Ciri-ciri Kesetimbangan Kimia
1. Terjadi pada reaksi reversibel (reaksi yang dapat berjalan dua arah atau bolak-balik)
2. Bersifat dinamis.
3. Reaksi yang seolah berhenti, namun secara molekuler reaksi terus terjadi.
4. Reaksi meraih kesetimbangan ketika laju raksi ke kanan sama dengan laju reaksi ke kiri (V₁=V₂), sehingga perbandingan fokus reaktan dan produk itu tetap.
Jenis-jenis Kesetimbangan Kimia.
Didalam kesetimbangan kimia terdapat dua macam bentuk kesetimbangan daintaranya adalah; kesetimbangan statis dan kesetimbangan dinamis.
Kesetimbangan Statis adalah kesetimbangana yang mampu terjadi saat reaksi kimia yang dihasilkan ialah reaksi kimia satu arah atau reaksi kimia yang tidak mampu kembali lagi seperti semula.Contoh kesetimbangan statis seperti dikala kita memperabukan selembar kertas, maka abu yang dihasilkan dari pembakaran tersebut tidak dapat kembali lagi menjadi kertas.
Kesetimbangan Dinamis adalah kesetimbangan yang terjadi dikala reaksi kimia yang dihasilkan ialah reaksi kimia dua arah atau reaksi kimia yang mampu kembali lagi mirip semula. Contoh kestimbangan dinamis yaitu air yang dipanaskan menghasilkan uap yang jika terkena tutup atau benda yang ada didekatnya akan kembali berubah menjadi air.

Pemanasan air didalam panci tertutup (Sumber : Wikipedi.org, Ruangguru).
Persamaan Reaksi Dalam Kesetimbangan Kimia.
Dapat kita perhatikan bahwa, jikalau pada sebuah suhu yang tetap didalam sebuah gas pada bidang A yang berada dalam keadaan setimbang dengan gas pada bidang B, maka dapat dikatakan persamaan reaksi yang mampu dijabarkan adalah :
Jika gas pada bidang A dalam kondisi setimbang dengan gas pada bidang B, maka kecepatan pembentukan gas pada bidan B sudah niscaya sama dengan kecepatan pembentukan kembali gas pada bidang A.
Tetapan Dalam Kesetimbangan Kimia
Didalam tetapan kesetimbangan kimia ini terbagi menjadi dua tetapan adalah :
a. Tetapan Kesetimbangan Konsentrasi ( Kc).
Merupakan perbandingan hasil kali fokus dari produk yang di pangkatkan koefisiennya dengan hasil kali konsentrasi reaktan yang dipangkatkan. Dimana tetapan ini terbagi kembali menjadi dua yakni :
1. Kesetimbangan Homogen.
Merupakan jenis kesetimbangan yang terjadi saat produk dan reaktan berasal dari fase yang serupa, mirip; semuanya gas (g), atau semuanya cairan (aq).
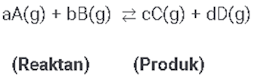
Maka diperoleh nilai kesetimbangan konsentrasi yang mampu disusun sebagai berikut :
Dimana :
Kc : Tetapan kesetimbangan
A : Molaritas zat A (M)
B : Molaritas zat B (M)
C : Molaritas zat C (M)
D : Molaritas zat D (M)
2. Kesetimbangan Heterogen
Merupakan kesetimbangan yang terjadi dikala produk dan reaktan mempunyai fase yang berlawanan. Dan yang mampu terpengaruh pada tetapan ini cuma pada bagian yang berwujud gas (g) dan cairan (aq). Misalnya mirip :
Nilai Kesetimbangan yang dapat disusun ialah :

Dimana :
Kc : Tetapan kesetimbangan
A : Molaritas zat A (M)
D : Molaritas zat D (M)
b. Tetapan Kesetimbangan Tekanan Parsial (Kp)
Merupakan fase dalam wujud gas yang dipertimbangkan menghipnotis tetapan keseimbangannya. Persamaan dari total tekanan parsial yang diperoleh ialah :
Kesetimbangan tekanan parsial terbagi menjadi dua reaksi dengan susunan persamaannya sebagai berikut :
Reaksi Homogen
Reaksi Heterogen
Reaksi heterogen ini memperhitungkan fase gas (g) yang mempengaruhi tetapan kesetimbangan.
c. Hubungan Kesetimbangan Homogen (Kp) dan Tekanan Parsial (Kc)
Hubungan kesetimbangan ini memiliki kaitan yang sangat bersahabat dimana secara matematis, korelasi keduanya tersusun selaku berikut :
Δn = total mol produk gas – total mol reaktan gas
Bila Δn = 0, maka Kp = Kc, mirip pada reaksi berikut :
2 HI(g) ↔ H₂(g) + I₂ (g)
Kesimpulan
Dalam pemaparan perihal persamaan reaksi dan tetapan kesetimbangan kimia ini pasti mesti betul-betul diperhatikan bagaimana reaksi dari zat yang mendapat tekanan, penerapan lambang kimia yang mesti benar dan keterkaitan antara reaksi yang ditimbulkan oleh masing-masing zat kimia. Sehingga kita mampu memberikan perlakuan yang sungguh-sungguh tepat pada kesetimbangan kimia tersebut.
Referensi :
https://www.ruangguru.com/blog/kesetimbangan-kimia-jenis-jenis-reaksi-dan-tetapan
https://www.zenius.net/blog/bahan-kesetimbangan-kimia#Tetapan_Kesetimbangan








