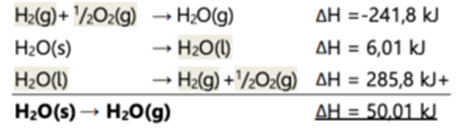Oleh : Muhammad IzzulHaq @W14-IZZULHAQ
Termodinamika merupakan salah satu alat konseptual yang berguna dalam memahami sains titik paradigma utama termodinamika adalah kesemestaan hukum-hukumnya sehingga banyak kesimpulan fisik dapat di edukasi dari beberapa aturan termodinamika melalui Hukum Termodinamika mampu dikenali bahwa sebuah proses kimia akan terjadi atau tidak mungkin terjadi pada keadaan tertentu sehingga mampu meminimalisir banyak waktu dan biaya.
Selain itu, Termodinamika juga bekerjasama dengan mekanika statik. Cabang ilmu Fisika ini mempelajari sebuah pertukaran energi dalam bentuk kalor dan kerja, sistem pembatas dan lingkungan. Aplikasi dan penerapan Termodinamika bisa terjadi pada badan insan, kejadian meniup kopi panas, perkakas elektro, Refrigerator, mobil, pembangkit listrik dan industri, yaitu insiden Termodinamika yang paling dekat dengan kehidupan sehari-hari.
Jadi, bahwasanya ilmu Fisika ini berkaitan satu sama lain, itulah kenapa mengerti setiap rancangan itu penting, sebab dengan begitu elo akan mudah mengetahui korelasi antar keduanya.
Singkatnya, thermodinamika mempelajari perihal panas dan temperatur, termasuk korelasi keduanya pada energi dan gerak.
Hukum Dasar Termodinamika terbagi menjadi 4 yaitu :
1. Hukum Awal(Zeroth Law) Termodinamika ( 0 )
Hukum awal menyatakan bahwa dua metode dalam keadaan setimbang dengan sistem ketiga, maka ketiganya dalam saling setimbang satu dengan yang lain. Hukum ini dimasukkan setelah aturan pertama.
2. Hukum Pertama Termodinamika
Hukum yang sama juga terkait dengan masalah kekekalan energi. Hukum ini menyatakan pergeseran energi dalam dari suatu tata cara termodinamika tertutup sama dengan total dari jumlah energi kalor yang disuplai ke dalam metode dan kerja yang dilaksanakan terhadap metode. Hukum ini mampu diuraikan menjadi beberapa proses, yakni proses dengan Isokhorik, Isotermik, Isobarik, dan juga adiabatik.
3. Hukum kedua Termodinamika
Hukum kedua termodinamika terkait dengan entropi. Tidak ada suara untuk aturan kedua termodinamika yang ada hanyalah pernyataan kenyataan eksperimental yang dikeluarkan oleh kelvin-plank dan clausius. Pernyataan clausius: tidak mungkin sebuah sistem apapun melakukan pekerjaan sedemikian rupa sehingga hasil satu-satunya adalah perpindahan energi sebagai panas dari sistem dengan temperatur tertentu ke tata cara dengan temperatur yang lebih tinggi. Pernyataan kelvin-planck: mustahil sebuah tata cara beroperasi dalam siklus termodinamika dan menunjukkan sejumlah netto kerja kesekeliling sambil mendapatkan energi panas dari satu reservoir termal.(sumber Fundamentals of engineering thermodynamics (Moran J., Shapiro N.M. – 6th ed. – 2007 – Wiley) Bab5).
” Total entropi dari sebuah metode termodinamika terisolasi condong untuk berkembangseiring dengan meningkatnya waktu, mendekati nilai maksimumnya hal ini disebut dengan prinsip peningkatan entropi” ialah korolari dari kedua pernyataan diatas (analisis Hukum kedua termodinamika untuk proses dengan menggunakan sifat entropi)(sumber Fundamentals of engineering thermodynamics (Moran J., Shapiro N.M. – 6th ed. – 2007 – Wiley) Bab6).
4. Hukum ketiga Termodinamika
Hukum ketiga termodinamika terkait dengan temperatur nol absolut . Hukum ini menyatakan bahwa pada dikala suatu metode meraih temperatur nol absolut, semua proses akan berhenti dan entropi sistem akan mendekati nilai minimum. Hukum ini juga menyatakan bahwa entropi benda berstruktur kristal sempurna pada temperatur nol adikara bernilai nol.
Berdasarkan sifat batas sistem-lingkungan dan perpindahan, kalor dan entropi antara tata cara dan lingkungan, tata cara pada termodinamika dibagi menjadi 3, adalah:
– Sistem Terbuka merupakan pertukaran – pertukaran massa dan energi sistem dengan lingkungannya lingkungannya.
Misal : lautan, tumbuh-flora tumbuha
– Sistem Tertutup Yaitu pertukaran – pertukaran energi namun TIDAK terjadi terjadi pertukaran pertukaran massa system dengan lingkungannya lingkungannya.
Misalnya Misalnya: Green House Green House ada pertukaran pertukaran kalor tetapi tidak terjadi terjadi pertukaran kerja pertukaran kerja dengan lingkungan lingkungan.
– Sistem Terisolasi Yaitu tidak ada pertukaran pertukaran massa dan energi sistem dengan lingkungan lingkungan.
Misalnya Misalnya: Tabung gas yang gas yang terisolasi.
ENERGI PADA REAKSI KIMIA (TERMOKIMIA)
Pengertian
Termokimia yaitu cabang ilmu kimia yang mengamati aspek suhu dalam reaksi. Sistem yakni segala bentuk proses yang menjadi pusat perhatian pengamat. Contoh: keadaan zat, reaksi, pergantian zat. Sistem terdiri dari :
1) Sistem terbuka, adalah metode dapat mengalami pertukaran energi dan bahan dengan lingkungan.
2) Sistem tertutup, adalah sistem mampu mengalami pertukaran energi dengan lingkungan, tidak dengan pertukaran materi.
3) Sistem terisolasi, yaitu metode tidak dapat mengalami pertukaran energi dan bahan dengan lingkungan.
Reaksi Eksoterm dan Endoterm
Dalam konsep termokimia, reaksi terbagi menjadi dua, adalah reaksi eksoterm dan reaksi endoterm.
1. Reaksi eksoterm, ialah reaksi yang sistemnya membebaskan/melepas energi, sehingga lingkungan menjadi naik temperaturnya. Contoh: reaksi diatas suhu kamar (pembakaran), pelarutan NaOH, reaksi Mg dengan HCl.
2. Reaksi endoterm, ialah reaksi yang sistemnya menyerap/mendapatkan energi, sehingga lingkungan menjadi turun temperaturnya. Contoh: reaksi Ba(OH)2 dengan NH4Cl, pemanasan CuCO3.
Dalam kedua reaksi, terjadi pergeseran tingkat energi yang disebut pergantian entalpi reaksi, dapat dihitung :
Diagram tingkat energi memperlihatkan nilai perubahan entalpi reaksi.
Entalpi reaksi ditentukan dengan:
1) Menggunakan kalorimetri.
2) Menggunakan aturan Hess (penjumlahan).
3) Menggunakan data entalpi pembentukan.
4) Menggunakan data energi ikatan.
Kalorimeter yakni sistem terisolasi, sehingga semua energi yang diharapkan atau dibebaskan tetap berada dalam kalorimeter. Dengan mengukur perubahan suhu, kita mampu menentukan jumlah energi kalor reaksi dan entalpi reaksi :
Menurut hukum Hess, suatu reaksi mampu terjadi lewat beberapa tahap reaksi, dan bagaimanapun tahap atau jalan yang ditempuh tidak akan mempengaruhi entalpi reaksi. Perubahan entalpi reaksi berdasarkan hukum Hess:
1) Hanya tergantung pada kondisi permulaan dan selesai sistem, bukan tahap yang ditempuh.
2) Merupakan penjumlahan entalpi reaksi dari setiap tahap.
Contoh :
Tentukan perubahan entalpi penguapan air dari wujud padat kalau dikenali reaksi-reaksi berikut:
H2(g) + 1 /2O2(g) → H2O(g) ΔH = -241,8 kJ
H2O(l) → H2O(s) ΔH = -6,01 kJ
H2(g) + 1 /2O2(g) → H2O(l) ΔH = -285,8 kJ
Jawab :
Reaksi yang dikehendaki: H2O(s) → H2O(g) Berarti, seluruh H2O(s) diletakkan disebelah kiri (reaktan), dan H2O(g) ditaruh disebelah kanan (produk), sehingga ketiga reaksi diatas menjadi:
Dari rancangan aturan Hess, energi kalor sebuah reaksi berarti juga mampu ditentukan dari data entalpi pembentukan reaktan dan produknya.
Bentuk reaksi
umum: