Mengenal Niels Bohr – Sebelum membahas perihal model atom Bohr, mari terlebih dulu mengenal siapa itu Niels Bohr. Niels Bohr ialah ilmuwan Fisika asal Denmark. Ia dikenal sebagai penemu awal rancangan mekanika kuantum untuk versi atom. Bohr pernah menerima kado Nobel Fisika pada tahun 1922.
Model Atom Bohr
Niels Bohr pada tahun 1913, memperbaiki versi atom yang diusulkan Rutherford dengan memasukkan prinsip perembesan dan pemancaran radiasi elektron yang dikemukakan Planck. Untuk memperbaiki model tersebut usulan Bohr antara lain:
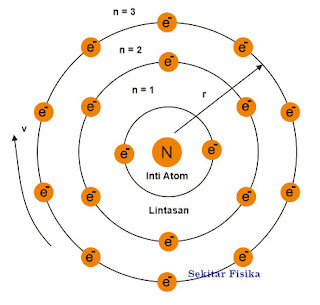
a. Elektron dalam atom bergerak mengelilingi inti pada lintasan-lintasan tertentu, tidak memancarkan energi. Lintasan-lintasan elektron itu disebut kulit atau tingkat elektron.
b. Elektron dapat berpindah dari satu lintasan ke lintasan yang lain.
c. Perpindahan elektron dari tingkat energi tinggi ke rendah disertai pemancaran energi. Sedang peripindahan elektron dari tingkat energi rendah ke tinggi diikuti peresapan energi.
d. Elektron yang bergerak pada lintasannya berada pada keadaan stasioner, artinya elektron tidak memancarkan atau menyerap.
Model atom juga menampung perihal rancangan bilangan kuantum dan tingkat energi yang terkuantisasi. Keduanya ini memainkan peranan penting dalam pengertian perihal struktur atom berikutnya bilangan kuantum n disebut bilangan kuantum utama, yang ialah kulit elektron.
Model atom Bohr digambarkan bahwa atom sebagai suatu inti kecil bermuatan aktual yang dikelilingi oleh elektron yang bergerak dalam orbit sirkuler mengelilingi inti seperti halnya tata cara tata surya, akan tetapi tugas gravitasi diganti dengan gaya elektrostatik. Adapun model atom Bohr ditunjukkan pada gambar 1.
Gambar 1. Model Atom Bohr
Kelebihan dan Kekurangan Teori Atom Bohr
Teori Atom Bohr selain memiliki keunggulan juga mempunyai kekurangan. Adapun beberapa keunggulan dan kekurangan teori atom Bohr dijelaskan mirip berikut ini:
Kelebihan Teori Atom Bohr
Model atom Bohr sukses menjelaskan spektrum yang termati hidrogen dan ion-ion serupa atom hiidrogen, mirip atom H+ dan L2+ .
Kekurangan Teori Atom Bohr
Model atom Bohr tidak mampu menjelaskan spektra atom yang memiliki lebih dari satu elektron. Selain itu model atom Bohr tidak dapat menerangkan cara-cara atom berhubungan membentuk molekul stabil dengan variasi tertentu dari atom-atom penyusunnya. Demikian pula perihal asumsi bahwa sebuah elektron dalam atom terletak pada jarak tertentu dari inti dan bergerak mengitari inti pada lintasannya dengan sebuah kecepatan tertentu. Hal ini kemudian ditunjukkan oleh Heinsenberg bahwa tidak mungkin untuk menentukan secara serentak posisi dan momentum sebuah partikel sub-atomik dengan tepat.
Dengan kelemahan ini lalu para peneliti melalui usaha yang terus-menerus dan bersungguh-sungguh memperbaiki versi struktum atom yang diberikan oleh Bohr dengan memakai desain-desain secara mekanika kuantum.