Tahukah kalian bahwa sebetulnya dalam darah terdapat metode penjaga yang membantu agar pH darah hampir konstan, adalah 7,4?
Ya, tata cara penjaga itu ialah larutan penyangga. Larutan penyangga sangat dibutuhkan untuk mempertahankan kondisi pH karena bila terlalu asam atau terlalu basa mampu mengakibatkan banyak sekali problem.
Apakah larutan penyangga itu? Mari kita bahas pada bahan berikut.
Daftar Isi
Pengertian Larutan Penyangga
Larutan penyangga yakni larutan yang bisa menjaga derajat keasaman (pH) pada saat asam atau basa dimasukkan dalam suatu larutan. Larutan penyangga disebut juga “buffer” atau “penahan”.
Berikut ini yang termasuk dalam larutan buffer.
1. Campuran asam lemah dengan garam yang berasal dari asam lemah tersebut.
Contoh :
CH3COOH dengan CH3COOK
2. Campuran basa lemah dengan garam yang berasal dari basa lemah tersebut.
Contoh :
NH4OH dengan (NH4)2SO4
Larutan buffer memiliki sifat-sifat selaku berikut.
- Jika diencerkan maka pH larutan cuma sedikit berganti bahkan tidak terjadi pergeseran.
- Jika disertakan ke dalamnya sedikit asam atau basa maka pH larutan hanya sedikit berganti bahkan tidak terjadi perubahan.
Dengan sifat-sifat tersebut, pastinya larutan buffer mempunyai bermacam fungsi semoga pH larutan tetap stabil/konstan.
Baca juga Hidrokarbon.
Fungsi Larutan Penyangga
Larutan penyangga mempunyai bermacam fungsi, antara lain :
1. Darah selaku Larutan Penyangga
Terdapat faktor-faktor dalam pengendalian pH darah, antara lain penyangga karbonat, penyangga hemoglobin, dan penyangga fosfat.
a. Penyangga karbonat
Penyangga karbonat berasal dari gabungan asam karbonat (H2CO3) dengan basa konjugasi bikarbonat (HCO3–). Reaksinya sebagai berikut.
H2CO3 (aq) → HCO3– (aq) + H+ (aq)
Penyangga karbonat berperan penting dalam mengontrol pH darah agar tetap konstan.
b. Penyangga hemoglobin
Hemoglobin dalam darah dapat mengikat oksigen untuk dibawa ke seluruh sel badan. Reaksi kesetimbangannya sebagai berikut.
HHb + O2 (g) → HbO2– + H+
Adanya oksigen yang bersifat basa pada reaksi tersebut memengaruhi fokus ion H+ sehingga pH darah juga dapat dipengaruhi.
c. Penyangga fosfat
Dalam cairan intrasel, penyangga fosfat berperan penting dalam mengendalikan pH darah. Penyangga fosfat berasal dari adonan dihidrogen fosfat (H2PO4–) dengan monohidrogen fosfat (HPO32-). Reaksinya selaku berikut.
H2PO4– (aq) + H+ (aq) → H3PO4 (aq)
H2PO4– (aq) + OH– (aq) → HPO32- (aq) + H2O (aq)
Penyangga fosfat dapat mempertahankan pH darah 7,4. Penyangga di luar sel sungguh sedikit jumlahnya tetapi penting sekali untuk larutan penyangga urin.
2. Air Ludah sebagai Larutan Penyangga
Air ludah mengandung larutan penyangga fosfat yang dapat menjaga gigi dari kerusakan akhir adanya zat asam yang terbentuk dari fermentasi sisa-sisa makanan pada sela-sela gigi. Air ludah mampu mempertahankan pH lisan sekitar 6,8.
3. Menjaga Keseimbangan pH Tanaman
Setiap tanaman mampu berkembang dengan baik dalam pH tertentu sehingga diperlukan larutan penyangga biar pH mampu dijaga agar konstan.
4. Larutan Penyangga pada Obat-Obatan
Obat-obatan apabila tidak mengandung larutan penyangga dapat mengakibatkan perubahan pH pada perut, sehingga dapat menyebabkan problem lain dalam badan. Sehingga larutan penyangga ditambahkan dalam obat-obatan biar mampu mentransfer kelebihan asam atau basa yang berasal dari kandungan obat tersebut.
Derajat keasaman atau pH larutan penyangga mampu dikenali. Begitupula pH dari larutan penyangga yang telah disertakan sedikit asam atau basa. Bagaimana caranya? Mari kita pelajari pada subbab berikut.
Rumus Larutan Penyangga
1. Buffer asam (asam lemah + basa konjugasinya)
[H+] = Ka . 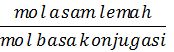
pH = – log [H+]
2. Buffer basa (basa lemah + asam konjugasi)
[OH–] = Kb . 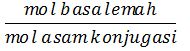
pOH = – log [OH–]
pH = 14 – pOH
Baca juga Konfigurasi Elektron.
Contoh Soal Larutan Penyangga
Sebanyak 200 ml larutan penyangga mangandung NH3 dan NH4Cl masing-masing 0,05 M.
- Tentukan pH larutan tersebut
- Tentukan pH larutan setelah ditambah 2 ml HCl 0,05 M
- Tentukan pH larutan sehabis ditambah 2 ml NaOH 0,05 M
(Kb NH3 = 1 . 10-5)
1. Menentukan pH Larutan
mmol NH3 = M . V = 0,05 . 200 = 10 mmol
mmol NH4Cl = M . V = 0,05 . 200 = 10 mmol
NH4Cl → NH4+ + Cl–
(garam) (asam konjugasi)
10 mmol 10 mmol
[OH–] = Kb . 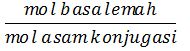
[OH–] = 10-5 . ![]()
[OH–] = 10-5
pOH = – log [OH–]
pOH = – log 10-5
pOH = 5
pH = 14 – pOH
pH = 14 – 5
pH = 9
Makara, pH larutan penyangga tersebut ialah 9.
2. Menentukan pH larutan sehabis ditambah 2 ml HCl 0,05 M
mmol HCl = M . V = 0,05 . 2 = 0,1 mmol
HCl → H+ + Cl–
0,1 mmol 0,1 mmol
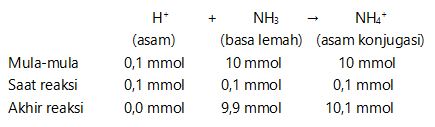
[OH–] = Kb . 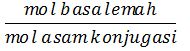
[OH–] = 10-5 . ![]()
[OH-] = 10-5 . 0,9802
pOH = – log 10-5. 0,9802
pOH = – log 10-5 – log 0,9802
pOH = 5 – (-0,0087)
pOH = 5,0087
pH = 14 – pOH
pH = 14 – 5,0087
pH = 8,9913
Kaprikornus, pH larutan penyangga setelah ditambah larutan HCl tersebut ialah 8,9913.
3. Menentukan pH larutan sesudah ditambah 2 ml NaOH 0,05 M
mmol NaOH = M . V = 0,05 . 2 = 0,1 mmol
NaOH → Na+ + OH–
0,1 mmol 0,1 mmol
[OH–] = Kb . 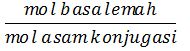
[OH–] = 10-5 . ![]()
[OH-] = 10-5 . 1,0202
pOH = – log 10-5 . 1,0202
pOH = – log 10-5 – log 1,0202
pOH = 5 – log 1,0202
pOH = 5 – 0,0087
pOH = 4,9913
pH = 14 – pOH
pH = 14 – 4,9913
pH = 9,0087
Makara, pH larutan penyangga setelah ditambah larutan NaOH tersebut adalah 9,0087.
Dari perkiraan-perkiraan di atas, terbukti bahwa dengan ditambahkannya sedikit asam atau basa ke dalam larutan penyangga, pH relatif konstan.
Demikian pembahasan mengenai larutan penyangga. Semoga dapat berguna. Baca juga Ikatan Hidrogen.