Banyak reaksi yang terjadi di sekeliling kita dengan kecepatan (laju reaksi) yang berbeda-beda.
Laju reaksi yang dimaksud di sini adalah laju berkurangnya jumlah reaktan atau laju bertambahnya jumlah produk dalam satuan waktu.
Dalam laju reaksi digunakan jenis fokus molaritas (M), dimana :
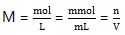
Selain itu, molaritas (M) juga dapat dimengerti dengan data persen larutan (P), massa jenis larutan (ρ), dan massa moekul relatif (Mr).
Persamaannya dapat dituliskan sebagai berikut.
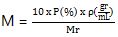
Untuk mengetahui lebih lanjut, mari kita pelajari bersama bab tentang laju reaksi.
Daftar Isi
Persamaan Laju Reaksi
Dalam persamaan reaksi :
pA + qB → rC + sD
maka laju reaksi (v) mampu dituliskan selaku berikut.
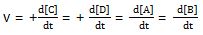
atau
v = k . [A]m . [B]n
dimana :
- v = laju reaksi
- k = tetapan reaksi
- m = orde reaksi zat A
- n = orde reaksi zat B
- (-) = berkurangnya reaktan
- (+) = bertambahnya produk
Baca juga Stoikiometri.
Orde Reaksi
Besarnya orde reaksi tergantung dari besarnya laju reaksi jika diberi perlakuan terhadap fokus reaktannya.
1. Reaksi orde nol
Pada reaksi kimia dengan orde nol, laju reaksi akan tetap meskipun telah dikerjakan perlakuan terhadap fokus reaktannya.
2. Reaksi orde satu
Pada reaksi kimia dengan orde satu, besarnya laju reaksi berbanding lurus dengan besarnya konsentrasi reaktan. Misalnya, jikalau fokus reaktan ditingkatkan 3 kali semula, maka laju reaksi juga akan berkembang3 kali dari semula.
3. Reaksi order dua
Pada reaksi kimia dengan orde dua, besarnya laju reaksi adalah pangkat dua dari kenaikan fokus reaktannya. Misalnya, jika konsentrasi reaktan ditingkatkan 2 kali semula, maka laju reaksi akan meningkat 22 atau 4 kali dari semula.
4. Reaksi orde negatif
Pada reaksi kimia dengan orde negatif, laju reaksi bebanding terbalik dengan fokus reaktannya.
Tidak semua reaksi kimia mampu diputuskan orde reaksinya cuma dari persamaan kimia, melainkan juga harus dari data eksperimen atau percobaan. Namun, sering kali hasil perhitungan orde reaksi sama dengan koefisien reaksi.
Baca juga Reaksi Kimia.
Faktor-Faktor yang Memengaruhi Laju Reaksi
< br/>
Laju reaksi dipengaruhi oleh banyak faktor, antara lain konsentrasi, luas permukaan, temperatur, dan katalis.
1. Konsentrasi
Secara lazim, laju reaksi mampu berjalan lebih cepat jikalau konsentrasi reaktan diperbesar.
Hal tersebut dikarenakan jumlah partikel yang lebih banyak sehingga partikel tersusun lebih rapat yang mengakibatkan tumbukan-tumbukan antarpartikel yang lebih banyak.
2. Luas Permukaan
Reaksi mampu terjadi kalau zat reaktan saling bersinggungan atau bercampur. Jika luas permukaan reaktan besar, bidang sentuhnya juga akan semakin besar, sehingga reaksi mampu berjalan lebih cepat.
Misalnya, jika zat reaktan berupa serbuk, maka reaksi akan lebih singkat terjadi dibandingkan dengan zat reaktan yang berupa belahan.
3. Temperatur
Laju reaksi akan lebih cepat jika temperaturnya meningkat. Hal tersebut dikarenakan semakin tinggi temperatur, maka energi kinetik partikel yang bertumbukan meningkat sehingga tumbukan makin sering terjadi.
Apabila v0 yaitu laju reaksi permulaan, va adalah laju reaksi tamat, t1 adalah usang reaksi pada suhu T1⁰C, t2 ialah lama reaksi pada suhu T2⁰C, dan ∆T ialah besar perubahan suhu sehingga laju reaksi menjadi ‘a’ kali laju semula, maka dapat dirumuskan :
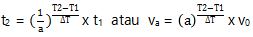
4. Katalis
Jika dalam reaksi ditambahkan sebuah katalis, energi aktivasi akan menurun sehingga reaksi akan lebih cepat terjadi karena zat-zat yang bereaksi lebih mudah melampaui energi aktivasi.
Umumnya, katalis ikut bereaksi namun pada final reaksi akan terbentuk kembali.
Baca juga Perkembangan Teori Atom.
Contoh Soal Laju Reaksi
1. Laju reaksi 2X + 3Y2 → 2XY3 dapat dinyatakan sebagai …
- Berkurangnya fokus X per satuan waktu
- Berkurangnya fokus Y2 per satuan waktu
- Bertambahnya fokus XY3 per satuan waktu
2. Umumnya laju reaksi akan meningkat 2 kali semula jika temperatur naik 10⁰C. Jika pada suhu 30⁰C laju reaksi sebesar 6 x 10-3 M/det, maka pastikan laju reaksi pada suhu 90⁰C.
a = 2
∆T = 10
T1 = 30
T2 = 90
v0 = 6 x 10-3 M/det
va = … ?
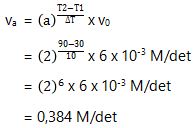
Kaprikornus, laju reaksi pada suhu 90⁰C adalah 0,384 M/det.
3. Pada reaksi 2A + B → C, diperoleh data sebagai berikut.
| No. | [A] M | [B] M | v (M/det) |
| 1 | 0,2 | 0,2 | 0,04 |
| 2 | 0,2 | 0,4 | 0,08 |
| 3 | 0,4 | 0,4 | 0,032 |
Tentukan :
- a. Orde reaksi
- b. Harga tetapan reaksi (k)
- c. Persamaan laju reaksi
a. v = k . [A]m . [B]n
Mencari orde A (m) dengan membandingkan konsentrasi B yang sama, adalah data 2 dan 3
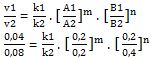
¼ = 1 . [½]m . 1, alasannya k1 = k2 = k3
¼ = [½]m
m = 2
Orde A (m) = 2
Mencari orde B (n) dengan membandingkan konsentrasi A yang serupa, yakni data 1 dan 2
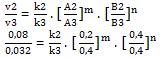
½ = 1 . 1 . [½]n, karena k1 = k2 = k3
½ = [½]n
n = 1
Orde B (n) = 1
Orde reaksi total = m + n = 2 + 1 = 3
Jadi, orde reaksi yaitu 3.
b. Karena k1 = k2 = k3, maka bebas ingin menggunakan data 1, 2, ataupun 3. Dalam perkiraan ini, dipakai data 1, dimana v1 = 0,04 M/det; [A] M = 0,2 M; orde A (m) = 2; [B] M = 0,2 M; dan orde B (n) = 1.
v1 = k1 . [A1]m . [B1]n
0,04 M/det = k1
. (0,2 M)2 . (0,2 M)1

k1= 5 M-2 det-1
Kaprikornus, harga tetapan reaksi (k) yaitu 5 M-2 det-1.
c. Persamaan laju reaksi = v = 5 . [A]2 . [B]1
Demikian pembahasan mengenai laju reaksi. Semoga mampu berfaedah. Baca juga Tata Nama Senyawa.