Apakah sebelumnya kalian pernah mempelajari tentang bilangan kuantum?
Jika pernah, pengetahuan tentang bilangan kuantum tersebut akan sungguh memiliki kegunaan untuk mempelajari bahan konfigurasi elektron pada kali ini.
Apa yang dimaksud konfigurasi elektron? Mari kita bahas gotong royong.
Daftar Isi
Pengertian Konfigurasi Elektron
Konfigurasi elektron ialah susunan elektron pada subkulit atom dalam orbital atom atau molekulnya.
Harus dikenang bahwa masing-masing orbital memiliki batas elektron yang dapat mengisinya. Berikut penjelasannya.
- Orbital s bisa diisi 2 elektron
- Orbital p bisa diisi 6 elektron
- Orbital d bisa diisi 10 elektron
- Orbital f bisa diisi 14 elektron
Aturan Penulisan Konfigurasi Elektron
Ada beberapa aturan yang digunakan untuk menuliskan konfigurasi elektron , yaitu :
1. Asas Aufbau
Berdasarkan asas Aufbau, pengisian elektron pada orbital dimulai dari subkulit yang mempunyai tingkat energi lebih rendah ke tingkat energi yang lebih tinggi.
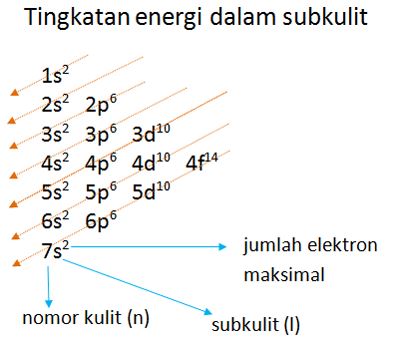
Contoh :
12Mg = 1s2 2s2 2p6 3s2
23V = 1s2 2s2 2p6 3s2 3p6 4s2 3d3
2. Aturan Hund
Berdasarkan hukum Hund, kalau elektron tersebar dalam orbital dengan tingkat energi yang serupa, elektron tidak akan berpasangan sebelum orbital tersebut terisi penuh.
Contoh :
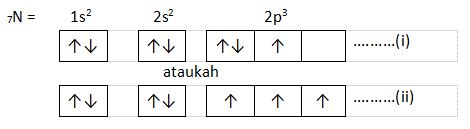
Manakah pernyataan di atas yang menyanggupi aturan Hund?
Yang memenuhi aturan Hund yakni penulisan pada nomor (ii), karena elektron mesti mengisi seluruh orbital terlebih dulu sebelum berpasangan.
3. Larangan Pauli
Berdasarkan larangan Pauli, dalam sebuah atom dihentikan terdapat dua elektron yang memiliki keempat bilangan kuantum (n, l, m, dan s) yang sama. Jika dua elektron menempati orbital yang serupa, maka bilangan kuantum spin dua elektron ini mesti berbeda.
Contoh :
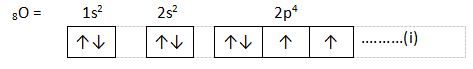
Pada orbital 2p4, masing-masing elektron pada orbital tersebut mempunyai keempat bilangan kuantum yang tidak sama.
Untuk bilangan kuantum subkulit ke -5, n = 2, l = 1, m = -1, s = +½
Untuk bilangan kuantum subkulit ke-6, n = 2, l = 1, m = 0, s = +½
Untuk bilangan kuantum subkulit ke-7, n = 2, l = 1, m = 1, s = +½
Untuk bilangan kuantum subkulit ke-8, n = 2, l = 1, m = -1, s = -½
Baca juga Larutan Elektrolit dan Non Elektrolit.
Konfigurasi Elektron Gas Mulia
Gas mulia yaitu bagian-unsur yang memiliki kestabilan yang sungguh tinggi dan dalam metode periodik terdapat pada kalangan VIIIA.
Gas mulia berisikan He (Helium), Ne (Neon), Ar (Argon), Kr (Kripton), Xe (Xenon), Rn (Radon). Sebagian bagian ini didapatkan di alam selaku komponen monoatomik.
Hal penting yang menyebabkan gas mulia mempunyai kesatabilan yang sungguh tinggi adalah konfigurasi elektronnya.
Berikut ini yakni konfigurasi elektron dari unsur gas mulia.
2He = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6
10Ne = 1s2 2s2 2p6
18Ar = 1s2 2s2 2p6 3s2 3p6
36Kr = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
54Xe = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6< /sup>
86Rn = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6
Konfigurasi elektron gas mulia biasa digunakan untuk menyingkat penulisan konfigurasi elektron bagian lainnya. Misalnya, penulisan elektron unsur 21Sc.
21Sc = 1s2 2s2 2p6 3s2 3p6 3d1 4s2
Jika disingkat maka menjadi
21Sc = [Ar] 3d1 4s2
Baca juga Hidrolisis.
Contoh Soal Konfigurasi Elektron
1. Unsur X mengandung 11 elektron sehingga memiliki konfigurasi elektron …
1s2 2s2 2p6 3s1
2. Deret bilangan kuantum yang tepat untuk elektron terakhir pada orbital 3d5 ialah …
n = 3, l = 2, m = +2, s = + ½
3. Tentukan jumlah elektron maksimum dalam suatu atom yang memiliki bilangan kuantum
n = 4, l = 2, dan m = 1.
n = 4, artinya elektron menempati kulit ke-4
l = 2, artinya elektron menempati subkulit d
m = 1 artinya elektron menempati orbital d yang ke-4
Jadi, dengan bilangan kuantum tersebut, orbital yang dimaksud mampu 3d4 (minimum) atau 3d9 (maksimum). Sehingga jumlah elektron maksimum dalam atom dengan konfigurasi elektron 1s2 2s2 2p6 3s2 3p6 4s2 3d9 atau 1s2 2s2 2p6 3s2 3p6 4s1 3d10 adalah 29.
Demikian pembahasan mengenai konfigurasi elektron. Semoga mampu berguna. Baca juga Hidrokarbon.