Tahukah kalian bagaimana proses pembuatan amoniak?
Dalam prosesnya, ada beberapa hukum yang mesti dipraktekkan biar amoniak yang dihasilkan maksimal. Salah satunya adalah dengan menambahtekanan.
Bagaimana hal tersebut dapat terjadi?
Kalian akan mengetahuinya sesudah mempelajari bab kesetimbangan kimia berikut ini.
Daftar Isi
Reaksi Kesetimbangan
Dalam reaksi kesetimbangan, terdapat reaksi satu arah (irreversibel) dan reaksi bolak-balik (reversibel).
Reaksi irreversibel disebut juga reaksi berkesudahan, dimana reaksi berlangsung dari kiri ke kanan dalam persamaan kimia dan apabila salah satu reaktan habis maka reaksi akan berhenti.
Dalam penulisannya dilambangkan dengan arah panah ke kanan. Contohnya yakni reaksi pembentukan natrium klorida (NaCl).
Reaksi : Pereaksi (reaktan) → hasil reaksi (produk)
NaOH + HCl → NaCl + H2O
Sedangkan reaksi reversibel adalah reaksi yang mampu berjalan dari dua arah, baik dari kiri ke kanan maupun dari kanan ke kiri.
Artinya setelah reaktan menghasilkan produk, produk tersebut mampu bereaksi kembali membentuk reaktan (reaksi dapat balik) secara mikroskopis (sedikit demi sedikit).
Reaksi reversibel ini nantinya akan meraih keadaan setimbang bila kecepatan reaksi ke kanan sama dengan kecepatan reaksi ke kiri.
Dalam penulisannya dilambagkan dengan arah panah bolak-balik. Contohnya adalah reaksi pembentukan gas amoniak (NH3).
Reaksi : Pereaksi (reaktan) ⇄ hasil reaksi (produk)
N2 (g) + 3H2 (g) ⇄ 2NH3 (g)
Berdasarkan wujud zat dalam reaksi setimbang, kesetimbangan terbagi menjadi dua, adalah kesetimbangan homogen dan kesetimbangan heterogen.
Kesetimbangan homogen adalah reaksi setimbang dimana zat-zat yang bereaksi baik reaktan maupun produk memiliki wujud yang sama (satu fase).
Contoh reaksi kesetimbangan homogen selaku berikut.
Reaksi :CH3COOH (aq) ⇄ CH3COO– (aq) + H+ (aq)
Sedangkan kesetimbangan heterogen ialah reaksi setimbang dimana zat-zat yang bereaksi memiliki wujud yang berbeda (dua fase atau lebih).
Contoh reaksi kesetimbangan heterogen sebagai berikut.
Reaksi :2NaHCO3 (s) ⇄ Na2CO3 (s) + CO2 (g) + H2O (g)
Kesetimbangan kimia bersifat dinamis dimana reaksi berjalan terus menerus pada ruang tertutup dengan suhu dan tekanan tetap, serta proses pergantian fokus secara mikroskopis.
Baca juga Gas Mulia.
Pergeseran Kesetimbangan
Berdasarkan Asas Le Chatelier yang berbunyi “Jika terhadap sebuah kesetimbangan dilakukan suatu langkah-langkah (agresi), tata cara itu akan mengadakan reaksi yang condong meminimalisir dampak aksi tersebut”, kesetimbangan mampu bergeser apabila diberi sebuah perlakuan.
Berikut ini yakni aspek-faktor yang memengaruhi kesetimbangan.
1. Perubahan Konsentrasi
Apabila dalam konsentrasi salah satu zat diperbesar, maka kesetimbangan akan bergeser ke arah yang bertentangan dari zat tersebut. Namun apabila konsentrasi salah satu zat diperkecil, maka kesetimbangan akan bergeser ke arah zat tersebut.
2. Perubahan Volume dan Tekanan
Apabila volume diperbesar = tekanan diperkecil, maka kesetimbangan akan bergeser ke arah zat yang jumlah koefisien reaksinya besar. Sedangkan bila volume diperkecil = tekanan diperbesar, maka kesetimbangan akan bergeser ke arah zat yang jumlah koefisiennya kecil.
3. Perubahan Suhu
Apabila suhu dinaikkan, maka kesetimbangan akan bergeser ke arah reaksi endoterm (membutuhkan kal
or). Sedangkan jika suhu diperkecil, maka kesetimbangan akan bergeser ke arah reaksi eksoterm (membebaskan kalor).
4. Pengaruh Katalis
Katalisator tidak merubah letak kesetimbangan karena harga kesetimbangan Kc tetap. Namun katalisator dapat mempercepat tercapainya kesetimbangan baik reaksi dari kiri ke kanan maupun sebaliknya dengan kecepatan yang sama besar.
Baca juga Sifat Koligatif Larutan.
Tetapan Kesetimbangan
Tetapan kesetimbangan kimia (K) merupakan perbandingan hasil kali data produk dengan hasil kali data reaktan yang masing-masing dipangkatkan dengan koefisiennya.
Tetapan kesetimbangan ini memiliki harga yang tetap. Dalam bab ini akan dibahas perihal tetapan kesetimbangan konsentrasi (Kc) dan tetapan kesetimbangan tekanan (Kp).
1. Tetapan Kesetimbangan Konsentrasi (Kc)
Tetapan ini berdasarkan data konsentrasi reaktan dan produk. Dalam perhitungannya, harga Kc tergantung dari apakah reaksi itu merupakan reaksi kesetimbangan homogen atau heterogen.
Dalam reaksi kesetimbangan homogen, berlaku rumus selaku berikut.
pA (g) + qB (g) ⇄ rC (g) + sD (g)
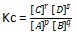
Sedangkan dalam reaksi kesetimbangan heterogen, berlaku rumus selaku berikut.
pA (g) + qB (s) ⇄ rC (g) + sD (g)
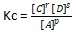
Pada reaksi heterogen, ada beberapa ketentuan dalam memperhitungkan harga Kc, antara lain ;
- Fase gas dan padat, penentu Kc yaitu fase gas
- Fase gas dan cair, penentu Kc ialah fase gas
- Fase padat dan larutan, penentu Kc adalah fase gas
- Fase gas, cair, dan padat, penentu Kc ialah fase gas
2. Tetapan Kesetimbangan Tekanan (Kp)
Tetapan ini berdasarkan data tekanan reaktan dan produk. Dalam perhitungannya, harga Kp hanya tergantung dari zat yang mempunyai fase gas, baik pada reaksi homogen maupun heterogen.
Rumus Kp yaitu sebagai berikut.
pA (g) + qB (g) ⇄ rC (g) + sD (g)
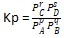
dimana :
- PA = tekanan parsial zat A
- PB = tekanan parsial zat B
- PC = tekanan parsial zat C
- PD = tekanan parsial zat D
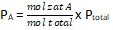
Dari perhitungan Kc dan Kp di atas, terdapat relasi di antara keduanya. Hal tersebut diperoleh menurut persamaan gas ideal, dimana
P . V = n . R . T ↔ P = n/v . R . T ↔ P = M . R . T
Makara, berdasarkan reaksi kesetimbangan berikut:
pA (g) + qB (g) ⇄ rC (g) + sD (g), diperoleh

Kp = Kc . (R.T)(r+s)-(p+q)
Baca juga Elektrolisis.
Contoh Soal Kesetimbangan Kimia
1. Berikut ini reaksi pengerjaan NH3 berdasarkan proses Haber Bosch.
N2 (g) + 3H2 (g) ⇄ 2NH3 (g), ∆H = -188,19 kJ
Supaya produk NH3 dihasilkan secara optimal, maka perlakuan yang benar yakni …
- Memperkecil volume
- Memperbesar tekanan
- Menurunkan suhu
- Memperbesar konsentrasi N2 dan H2
- Memperkecil konsentrasi NH3
2. 5 mol gas PCl3 dan 5 mol gas Cl2 diharapkan untuk membentuk 3 mol gas PCl5. Diketahui tekanan total sebesar 2,1 atm. Tentukan harga Kp.
Persamaan Reaksi : PCl3 (g) + Cl2 (g) ⇄ PCl5 (g)
Perhitungan :
| PCl3 (g) | + | Cl2 (g) | ⇄ | PCl5 (g) | |
| Mula-mula | 5 mol | 5 mol | – | ||
| Saat reaksi | 3 mol | 3 mol | 3 mol | ||
| Akhir reaksi | 2 mol | 2 mol | 3 mol |
mol total= mol PCl3 + mol Cl2 + mol PCl5
mol total = 2 mol + 2 mol + 3 mol
mol total = 7 mol

Makara, harga Kp untuk reaksi kesetimbangan tersebut yakni 2,5.
Demikian pembahasan mengenai kesetimbangan kimia. Semoga dapat bermanfaat. Baca juga Korosi.