Daftar Isi
Kesetimbangan Kimia: Jenis Jenis, Persamaan Reaksi, dan Tetapan
Oleh : Rifki Alfarizi (@V25-Alfarizi)
Ketika ada seseorang berbelanja kepasar membeli beras sebanyak 1 kg, kemudian penjualakan mengukur dengan anak timbangan yang memiliki massa sebesar 1 kg pula, kan? Tentu saja penjualtersebut juga akan memastikan agar berat beras dapat seimbang dengan anak timbangan. perkara ini ialah salah satu teladan dari kesetimbangan kimia. Semua benda yang membisu dan tidak bergerak mampu dikatakan selalu ada di dalam keadaan setimbang. Kesetimbangan kimia yaitu keadaan ketika kedua reaktan dan produk hadir dalam fokus yang tidak mempunyai kecenderungan lebih lanjut untuk berganti seiring berjalannya waktu.
Pengertian Kesetimbangan Kimia
Perhatikan reaksi di bawah ini!
A + B –> C
Jika A kita ibaratkan selaku terigu, kemudian akan kita campurkan dengan B kita misalkan sebagai telur, maka C kita ibaratkanlah sebagai adonan. A dan B yang posisinya di sebelah kiri panah bolak-balik kita sebut reaktan. Apabila A dan B tadi bercampur membentuk C berlangsung 10 menit. Setelah 10 menit A dan B sudah tak ada alasannya adalah seluruhnya sudah membentuk C. C yang ada di sebelah kanan panah disebut produk. Kaprikornus sehabis 10 menit gabungan terbentuk. Reaksi seperti ini disebut reaksi searah. Atau jikalau hasil sudah terbentuk memiliki arti reaksi sudah akhir. Jadi campuran atau si C yakni endingnya.

By food.detik.com
Contoh reaksi ini yakni, besi yang berkarat, kertas yang terbakar nasi yang berubah jadi bau. Semua reaksi itu reaksi 1 episode eksklusif selesai.
Nah, tapi ada juga reaksi kimia yang bolak balik, kok mampu bolak balik ya ?
Begini, misalkan reaksi yang tadi kan A campur B membentuk C, nah jika ternyata beberapa detik lalu, si C balik lagi membentuk A dan B maka reaksi inilah yang disebut reaksi bolak- balik, bahasa kerennya reversibel.
Makara andaikan adonan kudapan manis bisa berpisah kembali jadi terigu dan campuran secara utuh, nah mempunyai arti reaksi membuat kue yakni reversibel ye kan? Tapi gamungkin dong mampu balik lagi kan wkwkwk.
Reaksi bolak balik Kalau ditulis seperti ini nih bentuk reaksinya. Ada panah dengan dua arah.
A + B <==> C
Setelah beberapa detik A dan B terbentuk, eh beliau balik lagi C, begitu terus sebaliknya. Reaktan jadi produk, balik lagi produk jadi reaktan.
Komponen sebelah kiri panah ialah reaktan atau pereaksi, mereka semakin lama kian menyusut dikala akan membentuk C. Laju A dan B Disebutnya laju pengurangan.
Kemudian C makin lama kian bertambah sehingga laju reaksi nya disebut laju pertambahan.
Perhatikan, ini dia grafiknya.
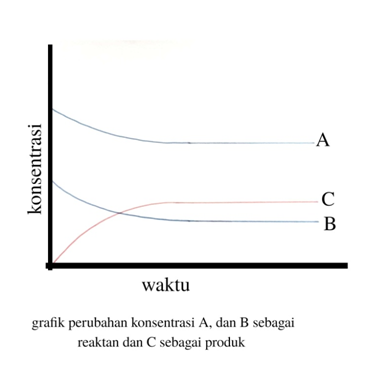
Garis A dan B tampakturun, alasannya adalah mereka menyusut dan mengalami laju pengurangan, sementara garis C terlihat naik, alasannya adalah C bertambah dan mengalami laju pertambahan.
Mengenai laju reaksinya, laju reaksi untuk laju pengurangan bermakna berkurangnya zat tersebut dalam hitungan waktu (detik). Jika laju pertambahan memiliki arti bertambahnya sebuah zat dalam hitungan waktu.
Simpelnya begini, misalkan si A asalnya 4 mol. Oh iya, mol ialah satuan yang biasa digunakan dalam reaksi kimia.
Nah sesudah 10 detik eh tinggal 2 mol berarti laju penghematan A tinggal kita minimalkan aja
Laju A = (mol selesai – mol awal)/detik
Laju A = (4 mol – 2 mol)/10 detik
Laju A = 0,2 mol/detik
Jika kita bicara laju pertambahan mempunyai arti ya hampir sama , kita mengkalkulasikan selisih mol permulaan dan mol selesai, sesudah itu dibagi waktu.
Laju C = mol selesai – mol permulaan
Konsep Dasar Kesetimbangan Kimia
Kita lihat lagi reaksi pembentukkan C dari A dan B mempunyai reaksi kesetimbangan:
A + B <==> C
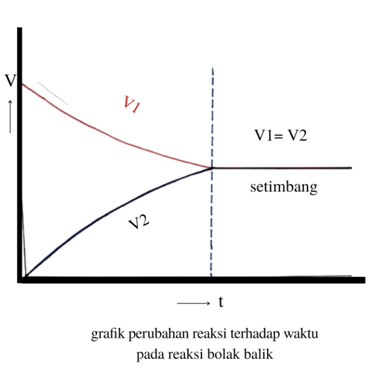
Kaitannya pada kesetimbangan reaksi di atas, Kesetimbangan kimia terjadi bila laju penghematan A dan B sama dengan laju pertambahan C. Meskipun mungkin hanya sesaat namun seolah-olah reaksi berhenti dikala laju penghematan dan laju pembentukan sama. Tapi ini tingkat makroskopis (secara kasat mata) ya, sesungguhnya tingkat mikroskopis alias molekul reaksi tetap berlangsung.
Faktor-aspek yang Mempengaruhi Kesetimbangan
Henri Louis Le Chatelier (1850-1936) Dia mempunyai teori bahwa :
”Bila terhadap sebuah kesetimbangan dijalankan suatu langkah-langkah (aksi) maka sistem itu akan mengadakan reaksi yang condong menghemat efek agresi tersebut”
Caranya beliau mampu geser ke kiri ialah arah reaktan atau geser ke kanan ialah arah produk.
Nah apa saja faktor-faktor yang menghipnotis pergantian kesetimbangan?
Jenis-Jenis Kesetimbangan Kimia
Kesetimbangan kimia terdiri atas dua macam, ialah kesetimbangan statis dan kesetimbangan dinamis. Kesetimbangan statis terjadi bila reaksi kimia yang dihasilkan merupakan reaksi kimia satu arah atau reaksi kimia yang tidak mampu kembali lagi mirip semula.
Sedangkan kesetimbangan dinamis terjadi jikalau reaksi kimia yang dihasilkan merupakan reaksi kimia dua arah atau reaksi kimia yang bisa kembali lagi mirip semula.
Ketika kau memperabukan selembar kertas, debu yang dihasilkan tidak dapat berkembang menjadi kertas lagi. Hal ini tergolong teladan kesetimbangan statis.
Akan tetapi, walau sama-sama menciptakan reaksi, air yang direbus hingga menciptakan uap akan memberi reaksi yang berlawanan dengan kertas yang dibakar menjadi bubuk. Mengapa? Sebab, jika uap terkena tutup panci atau benda yang lain maka akan berganti kembali menjadi air. Nah, hal ini disebut dengan kesetimbangan dinamis karena ada pergeseran dua arah.

Air yang direbus dalam panci tertutup (Sumber: wikipedia.org)
Kesetimbangan dinamis bekerja saat kecepatan reaksi pembentukan produk sama dengan kecepatan pembentukan reaktan. Ingat, dalam kesetimbangan dinamis akan selalu ada perubahan menuju produk dan pergeseran kembali menjadi reaktan. Kesetimbangan dinamis dilambangkan dengan tanda panah dua arah (⇌).
Persamaan Re
aksi Kesetimbangan Kimia
Jika suhu tetap gas A berada dalam keadaan setimbang dengan gas B, maka persamaan reaksinya mampu ditulis sebagai berikut:
aA(g) ⇌ bB(g)
Apabila gas A dalam kondisi setimbang dengan gas B, maka kecepatan pembentukan gas B pasti sama dengan kecepatan pembentukan kembali gas A. Sudah paham kan? Nah, tiap gas A berganti sebanyak a mol, maka B juga akan berubah sebanyak b mol. Perbandingan mol A dan mol B akan selalu tetap.
Tetapan Kesetimbangan Kimia
Merupakan angka yang menawarkan perbandingan secara kuantitatif antara produk dengan reaktan. Secara lazim reaksi kesetimbangan mampu dituliskan selaku berikut.
aA + bB ⇌ cC + dD
Saat di dalam reaksi kesetimbangan dilakukan aksi, maka kesetimbangan akan bergeser dan sekaligus mengganti komposisi zat-zat yang ada untuk kembali mencapai kesetimbangan. Secara biasa mampu dikatakan tetapan kesetimbangan merupakan perbandingan hasil kali molaritas produk dengan hasil kali molaritas reaktan yang masing-masing dipangkatkan dengan koefisiennya.
Referensi :
https://youtu.be/9XuUic3EklY
https://www.zenius.net/blog/bahan-kesetimbangan-kimia
https://ocw.ui.ac.id/mod/resource/view.php?id=8510