Daftar Isi
Kesetimbangan Kimia: Pengertian, Faktor-Faktor, dan Penerapannya
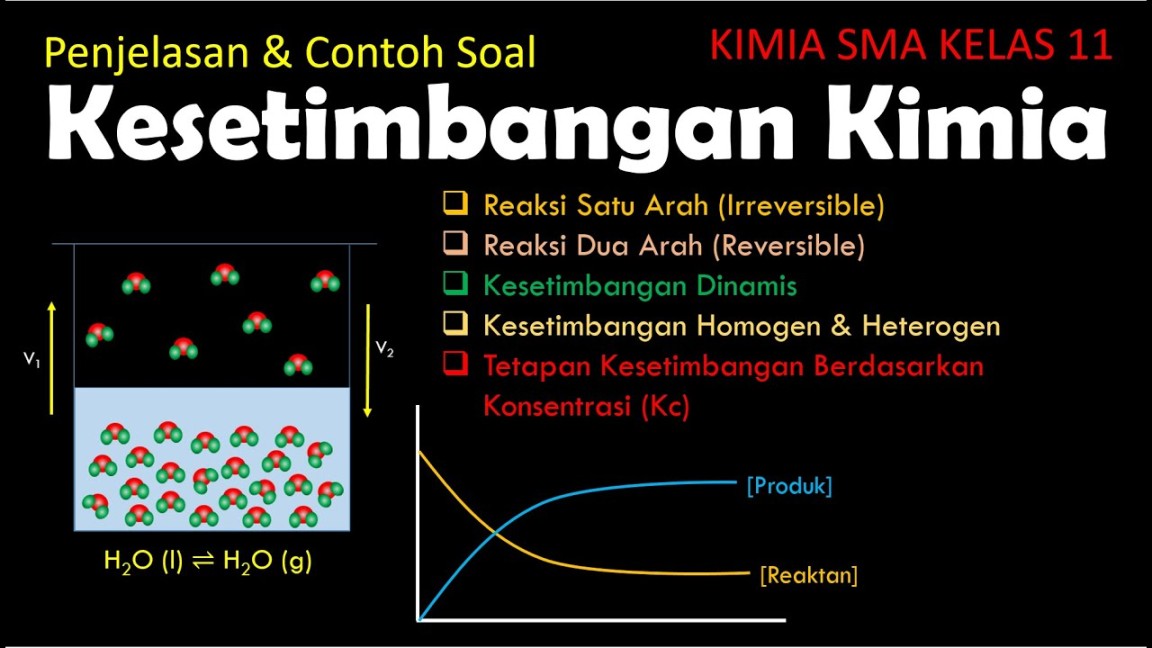
Pengertian Kesetimbangan Kimia
Kesetimbangan kimia merupakan kondisi di mana suatu reaksi kimia berlangsung dalam dua arah secara simultan, yaitu reaksi maju dan reaksi balik. Pada keadaan ini, laju reaksi maju sama dengan laju reaksi balik, sehingga tidak terjadi perubahan konsentrasi reaktan maupun produk secara makroskopis. Meskipun reaksi masih terus berlangsung, sistem berada dalam keadaan stabil.
Ciri-Ciri Kesetimbangan Kimia
Faktor-Faktor yang Mempengaruhi Kesetimbangan Kimia
Terdapat beberapa faktor yang dapat mempengaruhi kesetimbangan kimia, yaitu:
Konsentrasi
Perubahan konsentrasi salah satu komponen dalam reaksi akan menyebabkan pergeseran kesetimbangan. Penambahan konsentrasi reaktan akan menggeser kesetimbangan ke arah pembentukan produk, sedangkan penambahan konsentrasi produk akan menggeser kesetimbangan ke arah pembentukan reaktan.
Suhu
Perubahan suhu juga dapat mempengaruhi kesetimbangan. Reaksi eksoterm akan bergeser ke arah reaktan jika suhu dinaikkan, sedangkan reaksi endoterm akan bergeser ke arah produk jika suhu dinaikkan.
Tekanan
Perubahan tekanan hanya berpengaruh pada sistem kesetimbangan yang melibatkan gas. Peningkatan tekanan akan menggeser kesetimbangan ke arah jumlah mol gas yang lebih kecil, sedangkan penurunan tekanan akan menggeser kesetimbangan ke arah jumlah mol gas yang lebih besar.
Katalis
Katalis mempercepat laju reaksi baik maju maupun balik secara sama, sehingga tidak mempengaruhi posisi kesetimbangan, tetapi hanya mempercepat tercapainya kesetimbangan.
Penerapan Kesetimbangan Kimia dalam Kehidupan Sehari-hari
Prinsip kesetimbangan kimia diterapkan dalam berbagai bidang, seperti industri kimia, farmasi, dan lingkungan. Beberapa contoh penerapannya meliputi:
Proses Haber-Bosch: Pembuatan amonia untuk pupuk.
Kesimpulan
Kesetimbangan kimia merupakan konsep penting dalam kimia yang menjelaskan kondisi di mana reaksi berlangsung secara searah dan berlawanan dengan laju yang sama. Faktor-faktor seperti konsentrasi, suhu, tekanan, dan katalis dapat mempengaruhi posisi kesetimbangan. Pemahaman tentang kesetimbangan kimia sangat berguna dalam berbagai bidang industri dan lingkungan.
FAQs
Apa perbedaan antara kesetimbangan statis dan dinamis?
Kesetimbangan statis adalah kondisi di mana tidak terjadi perubahan sama sekali, sedangkan kesetimbangan dinamis adalah kondisi di mana reaksi terus berlangsung tetapi tidak ada perubahan konsentrasi secara makroskopis.
Bagaimana cara menentukan arah pergeseran kesetimbangan?
Arah pergeseran kesetimbangan dapat ditentukan dengan menggunakan prinsip Le Chatelier, yaitu sistem akan berusaha mengurangi pengaruh perubahan yang diberikan.
Apa itu tetapan kesetimbangan (Kc)?
Tetapan kesetimbangan adalah nilai konstanta yang menyatakan perbandingan konsentrasi produk dengan konsentrasi reaktan pada suhu tertentu.
Bagaimana pengaruh katalis terhadap kesetimbangan kimia?
Katalis tidak mempengaruhi posisi kesetimbangan, tetapi hanya mempercepat tercapainya kesetimbangan.
Apa pentingnya mempelajari kesetimbangan kimia?
Pemahaman tentang kesetimbangan kimia sangat penting dalam berbagai bidang, seperti industri kimia, farmasi, dan lingkungan.