Hukum Faraday yakni ilmu yang mempelajari tentang dasar elektromagnetisme yang merupakan proses pergeseran kimia menghasilkan arus listrik maupun sebaliknya.
Hukum ini dikemukakan oleh Michael Faraday, seorang ilmuwan asal Inggris yang bekerja dalam bidang elektrolisis.
Untuk mengenali lebih lanjut tentang hukum Faraday, mari kita pelajari bareng bab berikut ini.
Daftar Isi
Hukum 1 Faraday
Hukum 1 Faraday berbunyi, “Massa zat yang dihasilkan oleh sebuah elektrode selama elektrolisis(W) akan berbanding lurus dengan jumlah muatan listrik yang akan dipakai (Q)”. Berikut ini merupakan persamaan untuk menyatakan Hukum 1 Faraday.
W Q
Jumlah muatan listrik yang dipakai (Q) sama dengan hasil kali antara berpengaruh arus listrik (i) dan selang waktu (t).
Q = i × t
Berdasarkan eksperimen, 1 mol elektron sama dengan 1 Faraday yang memiliki muatan listrik sebesar 96.500 Coulomb. Hubungan tersebut mampu dirumuskan sebagai berikut.
Q = ne × F
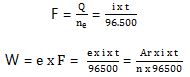
dimana :
- W = massa zat yang dihasilkan (gram)
- e = massa ekivalen zat
- i = berpengaruh arus listrik (Ampere)
- t = selang waktu (detik)
- Ar = massa atom relatif
- n = valensi zat
Hukum 2 Faraday
Hukum 2 Faraday berbunyi, “Massa zat yang dihasilkan oleh suatu elektrode selama elektrolisis (W) akan berbanding lurus dengan massa ekivalen zat yang digunakan (e)”.
Massa ekivalen zat ialah perbandingan dari massa atom relatif (Ar) dengan valensinya. Hukum 2 Faraday mampu dirumuskan sebagai berikut.
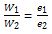
Baca juga Ikatan Kimia.
Contoh Soal Hukum Faraday
1. Jumlah faraday untuk mereduksi ion Ca2+ sebanyak 12 gram yaitu…
Ca2+ → valensi = 2
Ar Ca = 40
W= e x F
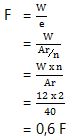
Jadi, untuk mereduksi 12 gram ion Ca2+ diharapkan 0,6 Faraday.
2. Pada elektrolisis dengan elektroda karbon dihasilkan endapan Cu sebanyak 12,7 gram dengan arus listrik yang digunakan sebesar 4 A. Berapa usang waktu yang diperlukan untuk elektrolisis tersebut?
Ar Cu = 63,5

Kaprikornus, lama waktu yang diharapkan untuk elektrolisis ialah 9650 detik.
3. Larutan Cu dapat membebaskan 7,95 gram logam Cu jikalau dialirkan sejumlah arus listrik. Berapa Ag yang dibebaskan dari larutan Ag+ bila dialirkan dengan jumlah arus listrik yang sama? (Diketahui Ar Cu = 63,5 dan Ar Ag = 108)
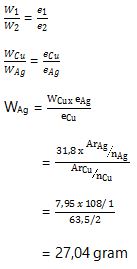
Jadi, jumlah Ag yang dihasilkan sebesar 27,04 gram.
Demikian pembahasan tentang Hukum Faraday. Semoga mampu bermanfaat. Baca juga Reaksi Redoks (Oksidasi-Reduksi).