Hukum Boyle : Pengertian, Rumus, Penerapan dan Contoh Soalnya – Pada pembahasan kali ini kami akan menjelaskan wacana aturan boyle. Yang meliputi perihal pengertian aturan boyle, rumus aturan boyle, penerapan hukum boyle dan contoh soal dari hukum boyle yang dibahas dengan lengkap dan ringan. Untuk lebih detailnya silakan simak ulasan dibawah ini dengan seksama.
Daftar Isi
Daftar Isi
Hukum Boyle : Pengertian, Rumus, Penerapan dan Contoh Soalnya
Mari kita diskusikan pengertian aturan boyle apalagi dahulu.
Pengertian Hukum Boyle
Hukum boyle ialah salah satu hukum fisika yang pembahasannya perihal bagaimana relasi antara tekanan dan volume pada suatu gas. Robert Boyle yaitu penemu dari hukum boyle pada tahun (1627-1691), ia menyelenggarakan sebuah observasi semoga dapap mengetahui keterkaitan antara tekanan dengan volume gas pada suhu yang konstan. Dari penelitiannya, Robert Boyle memperoleh bahwa produk tekanan dan volume gas dalam ruang tertutup adalah konstan.
Menurut Wikipedia, definisi lain dari hukum Boyle yaitu salah satu dari banyak aturan kimia dan kasus khusus dari hukum kimia yang ideal. Jika suhu tetap konstan dalam sistem tertutup, hukum Boyle menerangkan korelasi terbalik antara tekanan diktatorial dan volume udara.
Hukum Boyle, didapatkan oleh Robert Boyle, mempelajari pengaruh tekanan pada volume gas pada suhu tetap. Pernyataan Robert Boyle ini disebut Hukum Boyle, dan berbunyi:
“Pada suhu konstan, tekanan gas di ruang tertutup berbanding terbalik dengan volumenya.”
Dalam kehidupan sehari-hari, kita sering menjumpai acuan alat yang melakukan pekerjaan berdasarkan aturan Boyle, antara lain pompa sepeda, alat suntik, dan lain sebagainya.

Rumus Hukum Boyle
Menurut hukum Boyle, hal ini berarti bahwa hasil kali tekanan dan volume gas dalam ruang tertutup adalah konstan (tetap) pada keadaan suhu gas konstan.
Pernyataan diatas bila dituliskan dalam rumus, ialah:
P.V = C
Yang mana C merupakan bilangan tetap (konstanta). Apa jika tekanannya diubah maka jumlah gas juga akan berganti, maka rumus diatas dapat dituliskan sebagai berikut:
P1 . V1 = P2 . V2
Dengan ketentuan:
P1 = tekanan gas mula-mula (atm.cm Hg, N/m2, Pa)
P2 = tekanan gas akhir (atm, cm Hg, N/m2, Pa)
V1 = volum gas mula-mula (m3, cm3)
V2 = volum gas akhir (m3, cm3)
Hukum boyle hanya bisa berlaku pada keadaan:
- Suhu gas tetap atau konstan
- Gas ada didalam ruangan tertutup
- Tidak adanya reaksi kimia
- Tidak adanya pergantian wujud gas
Penerapan Hukum Boyle
Penerapan hukum boyle adanya pada prinsip kerja pompa. Pompa yaitu alat yang digunakan untuk memuat gas / cairan. Menurut prinsip kerja ini, pompa dibagi menjadi dua bagian yakni pompa hisap dan pompa tekanan.
Setelah terhirup, jumlah udara di dalam pompa bertambah, dan udara tidak bisa masuk ke dalam ban alasannya udara mesti masuk lewat katup (ventilasi) yang yang dibuat dari karet.
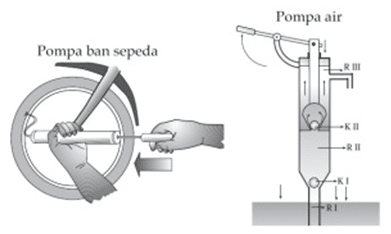
Jika lubang hisap ditekan, jumlah udara di dalam pompa akan berkurang, dan karena kenaikan tekanan, udara mampu masuk ke ban melalui tabung ventilasi. Alat serupa yang menggunakan prinsip hukum Boyle yakni jarum suntik, pipet, pompa tekanan, dan pompa air.
Contoh Soal Hukum Boyle
Berikut ini ialah pola soal mengenai aturan boyle:
1. Ruangan tertutup mempunyai gas di dalamnya dengan volume 200 ml. Jika tekanan ruangan 60cmHg, maka hitung tekanan gas dalam ruangan dengan volume 150 ml?
Penyelesaian:
Diketahui:
V1 = 200 ml
P1 = 60 cmHg
V2 = 150 ml
Ditanya: P2…?
Jawab:
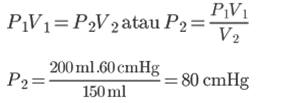
Tekanan gas di ruangan yang mempunyai volume 250 ml menurut aturan boyle adalah 80 cmHG.
2. Dalam Suatu ruang tertutup yang volumenya 0,2 m3 berisi gas denjika tekanan dinaikkan menjadi 80.000 Pa?
Penyelesaian:
Diketahui:
P1 = 60.000 Pa
V1 = 0.2 m3
P2 = 80.000 PaDitanya: V2…?
Jawab:
P1 V1 = P2 V2
V2 = (P1 V1) : P2
V2 = (60.000 x 0,2) : 80.000
V2 = 1,2/8
V2 = 0,15 m3 Makara, volume gas menjadi 0,15 M3
3. Pada hukum Boyle, p.V = k, k mempunyai dimensi …
A. Daya
B. Usaha
C. Momentum linier
D. Suhu
E. Konstanta pegas
Jawaban : B
Pembahasan :
Diketahui : V.p = k
Ditanya : k = …?
Jawab :
p.V = k
k = p.V = (m³)
k = Nm = Joule
Joule yaitu satuan perjuangan. Makara, k mempunyai dimensi perjuangan.
4. Di antara hal-hal berikut, yang bukan ialah syarat terjadinya hukum Boyle yaitu …
A. Suhu tetap
B. Volume dan tekanan tetap
C. Tidak terjadi reaksi kimia
D. Gas di ruang tertutup
E. Wujud gas tidak berganti
Jawaban : B
Pembahasan :
Hukum Boyle hanya berlaku dalam keadaan tertentu mirip suhu gas tetap, gas berada dalam ruang tertutup, tidak terjadi reaksi kimia, dan tidak terjadi perubahan wujud gas.
5. Dalam wadah tertutup,terdapat gas yang memuai sehingga volumenya menjelma 2 kali volume awalnya (V = volume awal, P = tekanan awal). Tekanan gas bermetamorfosis…
Pembahasan
Diketahui :
Tekanan awal (P1) = P
Volume permulaan (V1) = V
Volume tamat (V2) = 2V
Ditanya : tekanan tamat (P2)
Jawab :
P1 V1 = P2 V2
P V = P2 (2V)
P = P2 (2)
P2 = P / 2 = ½ P
Tekanan gas berkembang menjadi ½ kali tekanan permulaan.
6. Dalam wadah tertutup terdapat gas yang memiliki tekanan 2 atm dan volume 1 liter. Apa jikalau tekanan gas berubah menjadi 4 atm, volume gas menjadi …
Pembahasan
Diketahui :
Tekanan permulaan (P1) = 2 atm = 2 x 105 Pascal
Tekanan simpulan (P2) = 4 atm = 4 x 105 Pascal
Volume awal (V1) = 1 liter = 1 dm3 = 1 x 10-3 m3
Ditanya : Volume simpulan (V2)
Jawab :
P1 V1 = P2 V2
(2 x 105)(1 x 10-3) = (4 x 105) V2
(1)(1 x 10-3) = (2) V2
1 x 10-3 = (2) V2
V2 = ½ x 10-3
V2 = 0,5 x 10-3 m3 = 0,5 dm3 = 0,5 liter
7. Sebuah ruangan tertutup terdapat gas didalamnya dengan volume 200 mL. Apa bila tekanan ruangannya 60 cmHg, jadi hitunglah tekanan gas pada ruangan tersebut yang volumenya 150 mL?
Penyelesaian:
Diketahui:
V1 = 200 mL
V2 = 150 mL
P1 = 60 cmHg
Ditanyakan: P2 =…?
Jawaban:
P1 . V1 = P2 . V2
60 cmHg . 20 mL = P2 . 15 mL
P2 = 1200 cmHg/15
P2 = 80 cmHg
Demikianlah telah diterangkan ihwal Hukum Boyle : Pengertian, Rumus, Penerapan dan Contoh Soalnya, semoga mampu menambah pengetahuan dan pengetahuan kalian. Terimakasih telah berkunjung dan jangan lupa untuk membaca artikel lainnya.