Terdapat empat Hukum Dasar yang berlaku di dalam sistem termodinamika, yakni:
A. Hukum Awal (Zeroth Law/Hukum ke-0)
Bunyi Hukum Termodinamika 0 : “Jika dua metode berada dalam kesetimbangan termal dengan metode ketiga, maka mereka berada dalam kesetimbangan termal satu sama lain”
B. Hukum Pertama
1. Bunyi Hukum Termodinamika 1 : “Energi tidak sanggup diciptakan ataupun dimusnahkan, melainkan cuma sanggup diubah bentuknya saja.”
2. Rumus/Persamaan 1 Termodinamika:
Q = W + ∆U
Q = kalor/panas yang diterima/dilepas (J)
W = energi/perjuangan (J)
∆U = pergantian energi (J)
3. Hukum 1 Termodinamika dibagi menjadi empat proses, adalah
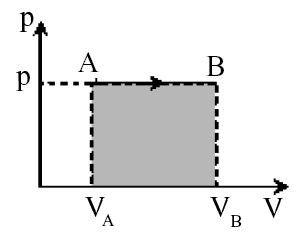
a. Proses Isobarik (tekanan tetap)
Proses isobarik yaitu proses pergeseran gas dengan tahanan tetap. Pada garis P – V proses isobarik sanggup digambarkan ibarat pada berikut.
Usaha proses isobarik sanggup ditentukan dari luas kurva di bawah gra fik P – V.
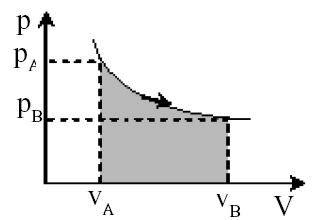
b. Proses Isotermis (suhu tetap)
Proses isotermis yakni proses perubahan gas dengan suhu tetap. Perhatikan gra fikk pada Gambar berikut.
Pada proses ini berlaku aturan Boyle.

Karena suhunya tetap maka pada proses isotermis ini tidak terjadi pergantian energi dalam ∆U=O . Sedang bisnisnya mampu dijumlah dari luas tempat di bawah kurva, besarnya mirip berikut.
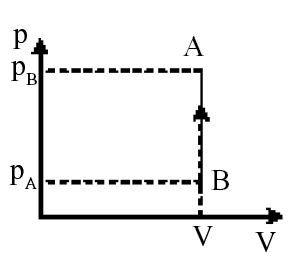
c. Proses Isokhoris (volume tetap)
Proses isokhoris ialah proses pergeseran gas dengan volume tetap. Pada grafik P.V sanggup digambarkan menyerupai pada Gambar berikut.
Karena volumenya tetap memiliki arti usaha pada gas ini nol,

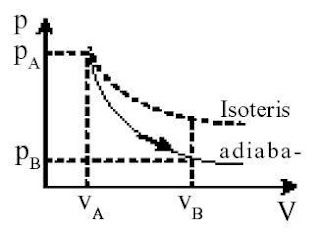
d. Proses Adiabatis (kalor tetap)
Pada proses isotermis sudah kita ketahui, U = 0 dan pada proses isokoris, W = 0. Bagaiaman jika terjadi proses termodinamika tetapi Q = 0 ?
Proses yang inilah yang dinamakan proses adiabatis. Berdasarkan aturan I Termodinamika maka proses adiabatis mempunyai sifat dibawah.


e. Proses Gabungan
Proses-proses selain 4 proses ideal diatas mampu terjadi. Untuk mempermudah penyelesaian mampu digambarkan grafik P – V prosesnya. Dari grafik tersebut mampu ditentukan usaha proses sama dengan luas kurva dan pergeseran energi dalamnya
Sedangkan campuran proses yakni adonan dua proses adiabatis yang berkesinambungan. Pada gabungan proses ini berlaku hukum I termodinamika secara menyeluruh.
C. Hukum Kedua
Bunyi Hukum Termodinamika 2 : “Kalor mengalir secara spontan dari benda bersuhu tinggi ke benda bersuhu rendah dan tidak mengalir secara spontan dalam arah kebalikannya.”
D. Hukum Ketiga
Bunyi Hukum Termodinamika 3 :
“Suatu metode yang meraih temperatur nol otoriter, semua prosesnya akan berhenti dan entropi sistem akan mendekati nilai minimum.”
“Entropi benda berstruktur kristal tepat pada temperatur nol sewenang-wenang bernilai nol.”
Baca Juga:
Pengertian, Klasifikasi, dan Sifat-sifat Sistem Termodinamika