Kesetimbangan Kimia :
Tetapan Kesetimbangan Kimia
Oleh : Cecep Syaripudin (@v09-cecep)
Semua benda yang diam dan tidak bergerak dapat dikatakan selalu ada di dalam keadaan setimbang. Prinsip kesetimbangan dalam reaksi kimia, pertama kali dikemukakan oleh Berthollt sewaktu menjadi penasehat ilmiah Napoleon di Mesir, sedangkan kajian secara laboratorium dilakukan oleh Guldberg dan Waage. Mereka menunjukkan bahwa reaksi kesetimbangan mampu didekati dalam dua arah, dan mereka berhasil memperlihatkan kekerabatan matematis antara fokus pereaksi dan produk dalam kesetimbangan. Pada potensi lain, van’t Hoff menganjurkan persamaan matematis untuk kesetimbangan dinamis, yaitu fokus pereaksi merupakan pangkat dari koefisien reaksinya.
Pada reaksi yang berjalan bolak balik, ada ketika dimana laju terbentuknya produk sama dengan laju terurainya produk menjadi reaktan. Pada kondisi ini, biasanya tidak terlihat lagi ada pergeseran. Keadaan reaksi dengan laju reaksi kekanan (maju) sama dengan laju reaksi sebaliknya (ke kiri) dinamakan kondisi setimbang.
Kesetimbangan kimia adalah keadaan saat kedua reaktan dan produk hadir dalam konsentrasi yang tidak memiliki kecenderungan lebih lanjut untuk berubah seiring berjalannya waktu.
Ciri-ciri kesetimbangan kimia :
- Terjadi pada reaksi reversible (reaksi yang mampu berlangsung dua arah atau bolak balik).
- Bersifat dinamis
- Reaksi seolah berhenti, tetapi secara molekuler reaksi terus terjadi.
- Reaksi meraih kesetimbangan ketika laju reaksi ke kanan sama dengan laju reaksi ke kiri (v1=v2), sehingga perbandingan konsentrasi reaktan dan produk itu tetap.
Kesetimbangan kimia terdiri atas dua macam, adalah kesetimbangan statis dan kesetimbangan dinamis. Kesetimbangan statis terjadi jikalau reaksi kimia yang dihasilkan ialah reaksi kimia satu arah atau reaksi kimia yang tidak mampu kembali lagi mirip semula. Sedangkan kesetimbangan dinamis terjadi jikalau reaksi kimia yang dihasilkan ialah reaksi kimia dua arah atau reaksi kimia yang bisa kembali lagi mirip semula.
Ketika kau membakar selembar kertas, abu yang dihasilkan tidak mampu berkembang menjadi kertas lagi. Hal ini tergolong teladan kesetimbangan statis. Akan namun, walau sama-sama menciptakan reaksi, air yang direbus sampai menghasilkan uap akan memberi reaksi yang berlawanan dengan kertas yang dibakar menjadi abu. Mengapa? Sebab, bila uap terkena tutup panci atau benda yang lain maka akan berubah kembali menjadi air. Nah, hal ini disebut dengan kesetimbangan dinamis karena ada pergantian dua arah.
A. Kesetimbangan Dinamis
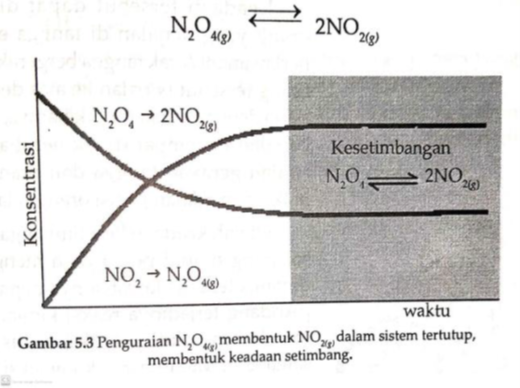
Untuk memahami kondisi kesetimbangan dalam metode kimia, tinjau reaksi disosiasi dinitrogen tetroksida dalam sistem tertutup dengan cara pemanasan. Persamaan reaksinya :
Dalam wadah, mula-mula (pada waktu, t = 0) hanya ada gas
Pada dikala yang sama, molekul-molekul NO2 hasil reaksi terasosiasi kembali membentuk N2O4, dan lajunya proporsional dengan konsentrasi NO2 yang terbentuk. Oleh alasannya adalah fokus NO2 pada awalnya sangat kecil, maka laju penguraian N2O4 membentuk NO2 lebih cepat dari pada laju asosiasi NO2 membentuk N2O4.
N2O4(g) ß NO2(g)
Oleh sebab laju penguraian gas N2O4 lebih singkat daripada perkumpulan gas NO2, maka konsentrasi NO2 yang terbentuk makin meningkat sejalan dengan waktu, yang pada akhirnya konsentrasi masing-masing gas dalam metode reaksi tidak berubah dan laju pada kedua arah reaksi sama. Pada kondisi ini dikatakan tata cara telah mencapai kondisi kesetimbangan, seperti ditunjukkan pada Gambar 5.3. Reaksi kimia dalam keadaan kesetimbangan dituliskan dalam bentuk persamaan berikut.
Dalam kesetimbangan, suatu keadaan mantap diraih secara kinetik, artinya laju pereaksi’membentuk produk sama dengan laju produk menjadi pereaksi. Pada keadaan itu, reaksi yang menuju produk dan reaksi yang menuju pereaksi berlangsung secara serempak dengan kecepatan yang sama sehingga fokus masing-masing zat tidak berganti terhadap waktu. Keadaan reaksi ini diidentifikasi sebagai kesetimbangan dinamis, seperti ditunjukkan pada Gambar 5.4.
B. Tetapan Kesetimbangan Kimia ,
Tetapan kesetimbangan dibagi menjadi 2 (dua) yakni tetapan kesetimbangan konsentrasi atau Kc, dan tetapan kesetimbangan tekanan parsial atau Kp.
Tetapan Kesetimbangan Konsentrasi (Kc)
Secara matematis, tetapan kesetimbangan fokus atau Kc yakni perbandingan hasil kali konsentrasi dari produk yang dipangkatkan koefisiennya dengan hasil kali konsentrasi dari reaktannya yang dipangkatkan koefisiennya. Tetapan yang satu ini dibagi lagi menjadi 2 (dua), yakni:
1. Kesetimbangan Homogen
Sesuai dengan namanya yang mengandung kata “homogen”, kesetimbangan ini merupakan jenis kesetimbangan yang terjadi pada dikala produk dan juga reaktan nya berasal dari fase yang sama, adalah seluruhnya gas (g) atau seluruhnya cairan (aq), mirip dibawah ini.
aA(g) + bB(g) ⇄ cC(g) + dD(g)
(Reaktan) (Produk)
Maka, nilai kesetimbangan konsentrasinya disusun sebagai berikut :
Kc = tetapan kesetimbangan
A = Molaritas zat A (M)
B = Molaritas zat B (M)
C = Molaritas zat C (M)
D = Molaritas zat D (M)
2. Kesetimbangan Heterogen
Banyak reaksi-reaksi kimia yang membentuk kesetimbangan berada dalam fase yang tidak homogen, dimana terdapat dua atau lebih fase hadir bersamasama dalam satu sistem kesetimbangan. kesetimbangan heterogen merupakan jenis kesetimbangan yang terjadi pada dikala produk dan reaktan memiliki fase yang berbeda. Di mana yang hanya menghipnotis tetapan kesetimbangan hanya unsur yang berwujud gas (g) dan cairan (aq). Misalnya sebagai berikut:
aA(aq) + bB(s) ⇄ cC(s) + dD(g)
(Reaktan) (Produk)
Maka, nilai kesetimbangan disusun sebagai berikut :
Di mana,
Kc = tetapan kesetimbangan
A = Molaritas zat A (M)
D = Molaritas zat D (M)
Tetapan Kesetimbangan Tekanan Parsial (Kp)
<
span face=""Arial","sans-serif"" style="font-size: 12pt; line-height: 150%; mso-fareast-font-family: "Times New Roman";">Berbeda dengan kesetimbangan konsentrasi atau Kc, pada tetapan kesetimbangan kimia tekanan parsial atau Kp cuma fase dalam wujud gas yang dipertimbangkan mempengaruhi tetapan keseimbangannya.
Untuk memilih tekanan parsial sebuah zat dari tekanan parsial totalnya digunakan persamaan sebagai berikut :
Kenapa diperlukan nilai P suatu zat ? Karena akan dipakai untuk mencari Kp-nya.
Sama halnya dengan tetapan kesetimbangan fokus, tetapan kesetimbangan tekanan parsial juga dibagi menjadi 2 (dua) adalah reaksi homogen dan heterogen. Dengan susunan persamaan sebagai berikut:
Reaksi Homogen
Reaksi Heterogen
Karena reaksi heterogen cuma memperhitungkan fase berwujud gas (g) yang menghipnotis tetapan kesetimbangan, maka susunan Kp kepada reaksi heterogen adalah sebagai berikut:
Hubungan Kc dan Kp
Lalu, apa kekerabatan antara Kc dan Kp? Secara matematis, relasi keduanya tersusun sebagai berikut :
Di mana,
R = konstanta 0,082 L atm/mol K
T = suhu Kelvin (K)
∆n = Ʃkoefisien produk – Ʃkoefisien reaktan
C. Manipulasi Tetapan Kesetimbangan
Pada kajian termokimia, persamaan termokimia dapat dimanipulasi melalui penjumlahan, pembalikan arah, atau perkalian koefisien reaksi dengan bilangan tertentu, operasi ini dapat mempengaruhi harga pergeseran entalpi. Serupa dengan itu, kesetimbangan kimia dapat dimanipulasi yang menghipnotis tetapan kesetimbangan, tetapi hukum mainnya berlawanan.
a. Penggabungan Persamaan Kesetimbangan
Jika dua atau lebih persamaan kimia yang mengandung komponen-bagian yang sama dalam keadaan kesetimbangan digabungkan, maka tetapan kesetimbangan hasil penggabungan merupakan perkalian dari tetapan kesetimbangan yang digabungkan, seperti ditunjukkan pada contoh berikut :
Penjumlahan kedua persamaan kimia tersebut menciptakan tetapan kesetimbangan yang nilainya sama dengan pekalian kedua tetapan kesetimbangan yang digabungkan : K3 = K1 x K2.
b. Pembalikan Arah Reaksi Kesetimbangan
Jika penulisan persamaan reaksi dalam kesetimbangan dibalikan, maka harga tetapan kesetimbangan baru ialah kebalikan dari tetapan semula. Misalnya, persamaan kesetimbangan berikut :
Kebalikan dari persamaan tersebut yaitu :
Ungkapan tetapan kesetimbangan untuk persamaan reaksi (a) dan reaksi (b) menciptakan kesimpulan bahwa tetapan kesetimbangan persamaan (b) sama dengan kebalikan dari persamaan (a), atau Kc=1Kc
Pergeseran kesetimbangan yakni perubahan dari kondisi kesetimbangan semula ke keadaan kesetimbangan yang baru akibat adanya aksi atau dampak dari luar. Henry Louis Le Chatelier, jago kimia Prancis (1852-1911) mengemukakan suatu pernyataan tentang perubahan yang terjadi pada metode kesetimbangan jikalau ada imbas dari luar. Pernyataan ini dikenal sebagai Azas Le Chatelier, yang berbunyi “Jika suatu tata cara kesetimbangan menerima sebuah agresi, maka metode tersebut akan mengadakan reaksi sehingga dampak aksi menjadi sekecil-kecilnya.”
DAFTAR PUSTAKA
Modul Kimia dan Pengetahuan Lingkungan Industri, Universitas mercu Buana. Jakarta Atep Afia Hidayat, Ir.MP. Kimia dan Pengetahuan Lingkungan Industri. 2021. Jakarta.
https://www.ruangguru.com/blog/kesetimbangan-kimia-jenis-jenis-reaksi-dan-tetapan
https://www.zenius.net/blog/materi-kesetimbangan-kimia