Di dlm teori ilmu kimia, kita mengenal hukum Avogadro atau yg pula dikenal dgn hipotesis Avogadro. Prinsip hukum ini didapat dr suatu percobaan yg menggunakan gas & berafiliasi dgn volume gas tersebut.
Penemunya bernama Avogadro, memiliki gagasan bahwa partikel suatu unsur tak semuanya bersifat tunggal atau monoatomik, tetapi mampu diatomin ataupoliatomik.
Hukum Avogadro ini merupakan salah satu aturan dasar yg penting dlm kimia. Di dalamnya membicarakan perihal perbandingan volume antar gas-gas yg nilainya sama dgn perbandingan molekul yg ada di dlm reaksi. Atau dgn arti lain, perbandingan volume ini sebanding dgn koefisien reaksi yg menyertainya.
Daftar Isi
Sejarah & Penemuan Hukum Avogadro
Dahulu di tahun 1811, seorang ahli di bidang kimia yg berasal dr Italia berjulukan Amadeo Avogadro mengemukakan suatu ide penting yg berhubungan dgn perbandingan volume gas. Gagasannya ini hingga sekarang digunakan dlm banyak perhitungan kimia.
Sebelumnya sudah di dapatkan suatu teori bahwa perbandingan volume gas-gas yg ada di suatu reaksi yaitu bilangan lingkaran & sederhana. Namun Gay Lussac, Dalton, & ilmuwan lain tak dapat menjelaskannya. Sedangkan Gay Lussac sendiri ialah penemu dr teori tersebut. Dalton gagal alasannya teorinya bahwa semua partikel suatu bagian selalu bersifat monoatomik atau tunggal.
Baca juga: Hukum Perbandingan Volume oleh Gay Lussac
Kemudian Avogadro menerangkan penyebab kenapa hal ini mampu terjadi, tepatnya di tahun 1811 tersebut. Ia mengungkapkan bahwa partikel suatu bagian tak semuanya bersifat monoatomik (tunggal). Namun menurutnya, partikel komponen bisa berupa diatomik (berbentuk2 atom), maupun poliatomik (lebih dr 2 atom).
Kemudian di sekitar era ke 19 hingga 20, andal fisika tak banyak mengenali massa molekul & atom. Namun kemudian lahirlah suatu teori hasil percobaan Millikan perihal elektron. Percobaannya yg menentukan muatan elektron ini kemudian menjadi landasan bahwa teori avogadro tersebut sungguh-sungguh kuat & akurat.
Penjelasan mengenai Hukum Avogadro
Berdasarkan apa yg sudah ditemukan oleh Avogadro, kemudian terbentuklah suatu aturan. Hukum tersebut berbunyi sebagai berikut.
“apabila terdapat dua sampel gas ideal yg memiliki volume, suhu, & tekanan yg sama, maka sampel tersebut mengandung molekul dgn jumlah yg sama pula”
Untuk mengerti teori ini, perhatikan acuan berikut. Apabila terdapat hidrogen & nitrogen yg mempunyai volume yg sama, keduanya niscaya mempunyai molekul dgn jumlah yg sama. Namun dgn catatan, kedua gas tersebut berada pada kondisi suhu pula tekanan yg sama pula. Dalam hal ini Avogadro menyebut partikel yaitu molekul.

Secara matematika, hukum atau hipotesis Avogadro ini dapat dinyatakan dgn rumus :
V / n = k
V untuk Volume gas, n untuk jumlah zat gas, & k yaitu tetapan atau konstanta. Ketetapan atau konstata dlm aturan Avogadro merupakan konstanta gas ideal yg mempunyai nilai yg sama bagi semua gas. Kondisi ideal yakni apabila suatu gas berada pada kondisi STP. Rumus konstanta yakni selaku berikut.
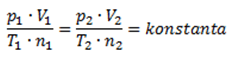
Dari rumus tersebut terdapat simbol P untuk tekanan suatu gas, sedangkan T untuk temperatur yg dinyatakan dlm satuan Kelvin.
Baca juga: Hukum Kekekalan Massa Oleh Antonie L. Lavoisier
Bilangan Avogadro & Konsep Mol
Di dlm hukum ini kita pula mengenal dgn adanya bilangan Avogadro. Ahli kimia dr Italia ini mengemukakan bahwa dlm 1 mol atom ada kurang lebih 6,02 x 1023 partikel. Bilangan ini kemudian disebut dgn Bilangan Avogadro yg sungguh berguna bagi perkiraan kimia. Bilangan Avogadro pula berlaku pada atom, senyawa, molekul, & seterusnya.
Coba perhatikanlah hubungan bilangan avogadro & Mol di bawah ini
1 mol komponen (contohnya: Na) terdapat 6,0225 x 1023 atom
1 mol senyawa (contohnya: H2O) terdapat 6,0225 x 1023 molekul
1 mol ion (misalnya: Cl–) terdapat 6,0225 x 102323 ion
dimana
mol bagian = gram/massa atom
mol senyawa= gram/massa rumus
Sumber :
Brady, James E. 1990. General Chemistry, (Principles & Structures). New York: John Wiley and Sons.
Chang, R. 2005. Chemistry. 8th ed. New York: Mc-Graw Hill.
Keenan, Charles E. et. al, – Pudjaatmaka. 1999. Ilmu Kimia Universitas (terjemahan). Jakarta: Erlangga.