Daftar Isi
Mengenal Perkembangan Teori-Teori Atom
Teori-Teori Atom – Suatu unsur mampu dibagi-bagi menjadi kepingan terkecil yg disebut atom. Atom ini memiliki sifat yg sama dgn serpihan yang lain dlm unsur yg sama & tak bisa dibagi lagi. Sebagai contoh, atom emas berlawanan dgn atom perak. Lalu bagaimana cara untuk membedakannya?
Teori Awal perihal Atom
Di periode 5 SM, Democritus, filsuf populer dr Yunani mengemukakan bahwa seluruh zat atau materi tersusun dr partikel-partikel yg sangat kecil. Selain itu ia menerangkan bahwa partikel tak mampu dibagi lagi atau disebut atomos. Kemudian John Dalton (1766-1844) menciptakan definisi “atom”. Teorinya yg sangat terkenal yg menjadi dasar perkembangan kimia modern yakni selaku berikut.
• Unsur terdiri dr partikel sangat kecil yg tak bisa dibagi lagi, atau disebut “atom”
• Atom yg menyusun unsur bersifat indentik sedangkan atom penyusun unsur lain bersifat berlawanan.
• Senyawa tersusun oleh atom-atom yg terdiri dr 2 unsur atau lebih. Perbandingannya pun tertentu & tetap.
• Atom-atom tersebut tak bisa diciptakan maupun dimusnahkan.
Struktur & Pekembangan Model Atom
1. Penemuan Elektron
Penemuan elektron didasari oleh inovasi tabung sinar katoda oleh Karl Ferdinan Braun yg disempurnakan oleh Sir William Crookes. Kemudian pada tahun 1879 JJ. Thomson memperoleh bahwasinar katoda yaitu bahan berskala amat kecil & mampu memutar baling-baling yg dipasang tepat di antara katoda & anoda.
Dari penyelidikannya, JJ. Thomson mampu memilih muatan elektron sebesar 1,76×108 coloumb/gram. Kemudian Millikan menyempurnakannya & mendapati bahwa muatan elektron yakni sebesar 1,6022×10-19 C & dijumlah masa 1 elektron sebesar 9,1×10-28 gram.
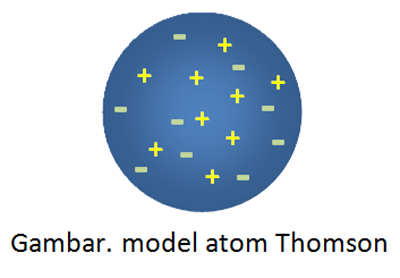
Dari percobaan Thomson, ia menyimpulkan bahwa sinar katoda yaitu penyusun atom. Teorinya model atomnya yg terkenal yakni roti kismis, dimana mewakili bentuk atom selaku bola pejal bermuatan nyata yg didalamnya tersebar muatan negatif elektron.
2. Penemuan Inti Atom & Proton
Eugene Goldstein di tahun 1886 memodifikasi tabung sinar katoda & didapatkan bahwa terdapat sinar yg arahnya bertentangan dgn sinar katoda & menembus lubang katoda (sinar terusan). Wilhelm Wien kemudian menjelaskan bahwa sinar tersebut adalah proton alasannya adalah bermuatan faktual. Lalu Ernest Rutherford melakukan percobaan mengenai hamburan sinar alfa kepada suatu lempengan emas yg tipis.
Kesimpulan yg didapat dr percobaan ini yaitu:
• Hampir seluruh partikel α diteruskan. Artinya atom bukanlah bola pejal namun sebagian meruakan ruangan kosong (hampa).
• Jika lempengan emas adalah lapisan atom-atom emas, maka didalamnya ada partikel kecil yg mempunyai muatan konkret.
• Partikel tersebut merupakan penyusun inti atom. 1 dr 20.000 partikel α dibelokkan. Jika dibandingan dgn diameter maka didapatkan bahwa ukuran inti kurang lebih 10.000 lebih kecil dr ukuran atom dengan-cara keseluruhan.
Kesimpulan diatas kemudian menenteng Rutherford pada anutan tentang model atom yg diketahui selaku model atom Rutherford. Ia mengemukakan bahwa inti atom berada di tengah sedangkan elektron mengelilinginya.
Baca juga: Partikel Penyusun Atom
3. Neutron
James Cadwick (1932) mengambarkan kebenaran adanya partikel lain di dlm ini atom menurut percobaan hamburan partikel α kepada parafin serta boron. Dari percobaan didapat bahwa adanya pancaran sinar mirip dgn gelombang elektromagnetik yg tak dibelokkan oleh medan magnet/listrik. Selain itu didapatkan pula bahwa sinar ini bersifat netral yg kemudian diberi nama neutron.
4. Model Atom Niels Bohr
Kelemahan model atom Rutherford kemudian mendorong Niels Bohr untuk mendapatkan model atom yg terbaik. Melalui percobaan spektrum hidrogen didapatkan bahwa elektron mengelilingi inti dlm orbitnya dgn energi yg konstan sehingga tak jatuh ke inti. Elektron pula mampu berpindah lintasan & memancarkan energi.
Selain postingan berjudul teori-teori atom di atas, Anda pula mampu membaca postingan serupa yg berjudul perkembangan teori atom.
Referensi :
Brady, James E. 1990. General Chemistry, (Principles & Structures). New York: John Wiley and Sons.
Chang, R. 2005. Chemistry. 8th ed. New York: Mc-Graw Hill.
Keenan, Charles E. et. al, – Pudjaatmaka. 1999. Ilmu Kimia Universitas (terjemahan). Jakarta: Erlangga.