Reaksi Reduksi & Oksidasi (Redoks) sering kita dapatkan dlm kehidupan sehari-hari misalnya pada reaksi pembakaran, pembuatan larutan cuka, reaksi metabolisme di dlm tubuh, & lain sebagainya.
Reaksi reduksi & oksidasi mengalami perkembangan sehingga mampu menjelaskan proses pergantian kimia dlm berbagai insiden.
Daftar Isi
Perkembangan Kosep Reaksi Redoks
Pada awalnya reaksi
oksidasi diartikan sebagai reaksi pengikatan oksigen oleh zat tertentu.
Sedangkan reaksi reduksi adalah reaksi pelepasan oksigen. Contoh reaksinya
yakni:
Oksidasi : H2(g) + ½ O2 (g) → H2 (l)
Reduksi : FeO (s) +
CO (g) → Fe (s) CO2 (g)
Namun pendapat tersebut dinilai kurang menerangkan reaksi kimia dengan-cara luas alasannya adalah banyak reaksi yg tak melibatkan oksigen. Kemudian desain redoks meningkat dimana reaksi oksidasi merupakan reaksi yg melibatkan pelepasan elektron & reaksi reduksi yaitu reaksi yg melibatkan pengikatan elektron.
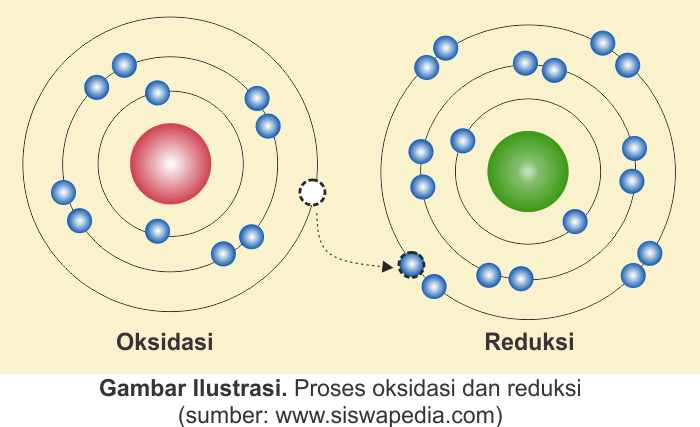
Konsep tersebut ditunjukkan oleh persamaan reaksi kimia berikut.
Na(s) + ½ Cl2
(g) → NaCl (s)
Reaksi di atas
melibatkan dua peristiwa:
Oksidasi : Na (s) → Na+ (s)
+ e–
Reduksi : ½ Cl2
(g) + e– → Cl– (s)
Konsep ini menerangkan bahwa pengikatan & pelepasan elektron terjadi dengan-cara serentak. Transfer elektron terjadi pada senyawa yg beriktan ion. Itu memiliki arti rancangan ini hanya mampu menerangkan reaksi yg melibatkan senyawa-senyawa ion namun tak mampu menerangkan reaksi yg melibatkan senyawa kovalen.
Artikel terkait: Metode lumpur aktif sebagai aplikasi redoks
Konsep redoks
berkembang yg menghasilkan teori bahwa terdapat sebuah bilangan yg disebut
dengan bilangan oksidasi.
Bilangan Oksidasi dlm Konsep Redoks
Bilangan oksidasi
ialah sebuah bilangan lingkaran yg menyatakan tingkat oksidasi suatu bagian yang
membentuk senyawa. Bilangan oksidasi atau biloks mampu ditentukan menurut
ikatan & struktur sebuah zat. Bilangan tersebut merupakan muataan riil suatu
ion dlm sebuah senyawa.
Pada senyawa kovalen, bilangan oksidasi ini merupakan skala tingkat keelektronegatifan masing-masing atom penyusun senyawa itu sendiri. Semakin tinggi elektronegatifan atom maka semakin berpengaruh daya tariknya terhadap pasangan elektron sehinga bernilai negatif.
Namun sebaliknya kalau keelektronegatifitas suatu atom lebih rendah maka nilainya kian positif.
Adapun aturan
penentuan bilangan oksidasi yakni selaku berikut.
- Atom di golongan IA seperti Li,
Na, K, Rb, Cs, serta Fr selalu mempunyai biloks +1 - Pada kelompok IIA seperti Be, Mg,
Ca, Sr, & Ba, selalu memunyai biloks +2 - Untuk golongan IIIA mirip atom
B, Al, serta Ga selalu mempunyai biloks +3. - Atom hidrogen atau H biasanya didalam
senyawa mempunyai bioloks +1, kecuali untuk senyawa-senyawa hidrida logam. - Senyawa hidrida logam seperti LiH,
CaH2, NaH, & seterusnya atom hidrogen memiliki biloks -1. - Umumnya atom oksigen atau O
mempunyai biloks -2, kecuali dlm senyawa-senyawa peroksida mirip H2O2,
Na2O2, & lain sebagainya. - Pada senyawa peroksida tersebut
atom O memiliki bilangan oksidasi bernilai +2.
Berikut Contoh Reaksi Redoks berdasarkan Bilangan Oksidasi
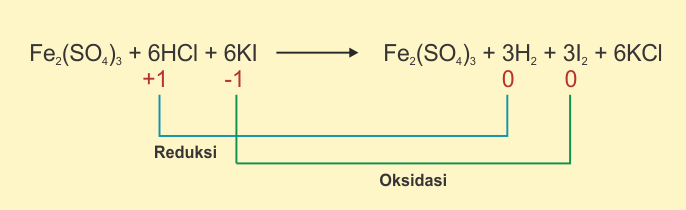
Perlu diingat bahwa reaksi oksidasi yaitu reasi yg melibatkan kenaikan bilangan oksidasi. Sedangkan reaksi reduksi ialah reaksi yg diliputi oleh penurunan bilangan oksidasi. Berikut beberapa misalnya.
Baca juga: Contoh soal hukum Faraday 1 & 2
Pengoksidasi & Pereduksi
Didalam reaksi redoks
atau reaksi reduksi oksidasi, terdapat biro pereduksi & biro pengoksidasi.
Pereduksi disebut pula reduktor, merupakan zat yg terlibat di dlm reaksi
redoks yg mengakibatkan zat lain mengalami reduksi. Sedangkan pengoksidasi atau
oksidator yg terdapat di dlm reaksi redoks akan menciptakan zat lain mengalami
oksidasi.
Dengan kata lain, zat reduktor akan mengalami oksidasi. Sedangkan zat oksidator akan mengalami reduksi. Pada acuan reaksi di bawah ini,
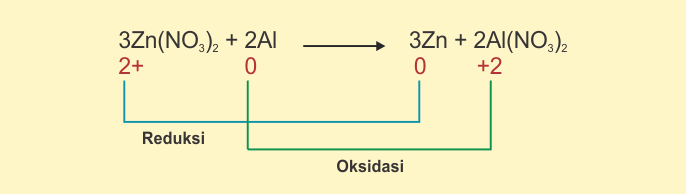
Zn(NO3)2
bertindak selaku oksidator, maka senyawa ini mengalami reduksi. Sedangkan Al
bertindak selaku reduktor sehingga mengalami oksidasi.