Pembahasan kemajuan teori atom pada halaman ini lebih kita tekankan pada nilai sejarah sehingga kita bisa mempunyai gambaran ihwal bagaimana teori atom ini mengalami penyempurnaan seiring kemajuan jaman.
Seperti yg sudah diterangkan pada halaman berjudul partikel penyusun atom disitu diterangkan bahwa perumpamaan atom berasal dr bahasa Yunani yg timbul dr suatu anutan bila sebuah materi misalnya kayu, kita potong-potong hingga pada ukuran kecil. Kemudian kita potong terus hingga meraih bagian ukuran tekecil yg tak bisa dibagi lagi, maka bagian tersebut kita namakan sebagai atom. Konsep anutan ini pertama kali dikemukakan oleh Democritus yg hidup pada tahun 460-370 Sebelum Masehi.
Pendapat democritus ini murni hanyalah berupa fatwa, bukan observasi ilmiah yg diikuti bukti-bukti dr hasil percobaan. Namun dlm perkembangannya, pemikiran Democritus ini menjadi semacam tantangan bagi kalangan ilmuwan sekaligus membuka pintu penelitian atom hingga dikala ini. Siapa saja peneliti yg menjajal menguak misteri atom? Simak penjelasannya berikut ini.
1. Teori atom Dalton
Jhon Dalton (1803) melakukan observasi kepada atom dgn menggunakan dua landasan teori yakni aturan kekekalan massa (berbunyi: “massa zat sebelum & sehabis reaksi sama”) & hukum perbandingan tetap (berbunyi:” perbandingan massa unsur-unsur dlm suatu senyawa adalah tetap & tertentu”).

Ada lima teori yg diajukan oleh Dalton yaitu:
- Atom merupakan partikel terkecil penyusun materi.
- Atom penyusun unsur bersifat identik.
- Atom penyusun unsur tak mampu dirubah menjadi atom penyusun unsur yang lain.
- Senyawa merupakan adonan dr dua atom atau lebih dgn perbandingan yg tetap & tertentu.
- Reaksi kimia terjadi alasannya adalah penghematan atau penambahan atom hingga membentuk senyawa yg baru.
Masih bingung dgn perumpamaan materi, unsur & senyawa? Baca artikel berjudul Materi & Wujudnya.
Teori atom Jhon Dalton ini hanya bisa bertahan dlm waktu 90 tahun. Pada tahun 1886, Eugene Goldstein mendapatkan partikel listrik bermuatan positif yg dinamakan proton. Kemudian pada tahun 1897, Thomson mendapatkan partikel bermuatan negatif yg dinamakan elektron. Disusul pada tahun 1932, James Chadwick pula mendapatkan muatan netral yg dinamakan neutron. Nah, versi atom Jhon Dalton ini dinilai lemah karena tak bisa menerangkan sifat kelistrikan pada atom.
2. Teori atom Thomson
Setelah melakukan percobaan memakai tabung sinar katoda, Thomson melihat atom dr sisi sifat kelistriknnya guna memperbaiki teori Dalton yg dinilai lemah. Menurut Thomson atom bersifat netral dimana di dalamnya terdapat muatan positif & muatan negatif yg saling menetralkan. Model atom Thomson mampu di lihat pada gambar di bawah ini.
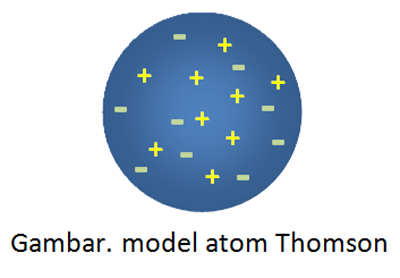
Model atom Thomson ini terkenal dgn sebutan versi atom roti kismis alasannya adalah seperti roti kismis. Atau jika di Indonesia seperti onde-onde, muatan positif & negatif itu ya mirip taburan biji wijen pada onde-onde.
3. Teori atom Rutherford
Philipp Lenard pada tahun 1903 beropini bahwa teori atom Thomson yg menyatakan atom berbentuk bola pejal dgn muatan positif & negatif yg saling menetralkan tidaklah benar. Pemikiran ini menjadi wangsit Ernest Rutherford (1911) untuk melakukan observasi lebih lanjut dgn dibantu dua asistennya yg bernama Hans Geiger & Ernest Marsden.
Rutherford melakukan observasi dgn cara menembakkan partikel alpha (α) yg bermuatan positif ke lempengan tipis emas. Di sekitar lempengan emas sudah dipasangi sensor pendeteksi hamburan sinar alpha dengan-cara melingkar.
Dari percobaan ini, diperoleh fakta diantaranya:
- Sebagian besar sinar alpha menembus lempengan emas. Itu artinya sinar alpha tak mengalami tabrakan dgn partikel penyusun atom. Dengan kata lain, di dlm atom terdapat banyak ruang hampa (bukan pejal).
- Sebagian kecil sinar alpha terbelokkan. Ini menunjukan sudah terjadi tabrakan antara partikel alpha (muatan positif) dgn inti atom (muatan positif). Bahkan ada yg dipantulkan kembali. Nah, yg dipantulkan kembali ini menabrak sempurna di tengah inti atom emas.
Kemudian ditarik kesimpulan bahwa atom terdiri dr inti atom bermuatan postif & dikelilingi oleh elektron yg bermuatan negatif dengn lintasan berupa bulat atau ellips. Dan mengajukan model atom seperti gambr di bawah ini.
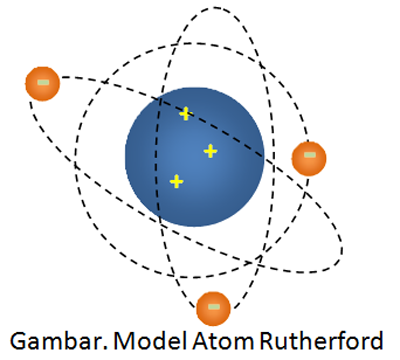
Model atom Rutherford pula dinilai mempunyai kekurangan alasannya adalah tak bisa menjawab pertanyaan kestabilan atom. Apabila elektron berputar mengelilingi inti, maka ia akan terus mengeluarkan energi sehingga bila energinya habis, maka elektron yg bermuatan negatif akan jatuh ke inti atom yg bermuatan positif (hukum Coulomb). Ini mengambarkan bahwa menurut versi atom Rutherford bahwa atom bersifat tak stabil . Hal ini bertentangan dgn pehamanan bahwa atom bersifat stabil.
Selain itu, faktanya bahwa spektrum atom hidrogen yg hanya mempunyai satu elektron ternyata spektrumnya berupa diskrit bukan kontinyu. Bila mengacu pada model atom Rutherford, semestinya spektrumnya berbentuk kontinyu alasannya elektron memancarkan energi radiasi.
4. Teori atom Niels Bohr
Untuk menyempurnakan teori atom Rutherford, Niels Bohr melakukan observasi spektrum atom dgn tetap berpegang teori mekanika kuantum Planck. Ia melaksanakan pemanasan terhadap atom Hidrogen sehingga mempunyai spektrum yg khas pada tingkatan energi tertentu. Ia melakukan pendekatan sesuai sifat dualisme yakni selaku partikel & gelombang.
Pada tahun 1913, Bohr menyampaikan dua postulat yakni:
- Elektron yg mengelilingi inti mempunyai orbit (kulit) tertentu. Elektron tak memancarkan atau menyerap energi sehingga hal inilah yg menciptakan energi elektron konstan.
- Jika elektron menyerap energi dr luar, maka ia akan naik ke kulit/orbit yg lebih tinggi kemudian akan kembali ke kulit/orbitnya yg semula sembari memancarkan energi radiasi.
Model atom Niels Bohr seperti pada gambar di bawah ini.
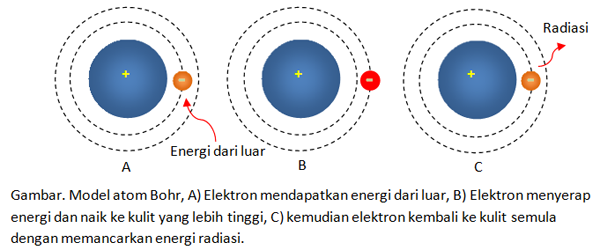
Gambar. Model atom Bohr, A) Elektron mendapatkan energi dr luar, B) Elektron menyerap energi & naik ke kulit yg lebih tinggi, C) kemudian elektron kembali ke kulit semula dgn memancarkan energi radiasi.
Model atom Bohr ini cuma bisa menerangkan keadaan atom sederhana, misalnya atom Hidrogen yg hanya dikelilingi satu buah elektron namun tak bisa menjelaskan keadaan atom yg dikelilingi oleh banyak elektron. Selain itu orbit elektron berbentuk ellips, bukan bundar sebagaimana yg dikemukakan Bohr.
5. Teori mekanika kuantum
Setelah observasi oleh Bohr lalu observasi ini dilanjutkan oleh Schrodinger, Heisenberg & Paul Dirac dimana diketahui bahwa orbital merupakan ruang kebolehjadian ditemukannya elektron. Dan bukan cuma itu saja, sebuah partikel yg bergerak pula mampu memancarkan gelombang. Kita akan membahasnya di halaman lain.
Daftar Pustaka:
Harnanto, Arie & Ruminten. 2009. Kimia I. Jakarta: Pusat Perbukuan Departemen Pendidikan Nasional.
Zulfikar. 2008. Kimia Kesehatan Jilid 1. Jakarta: Direktorat Pembinaan Sekolah Menengah Kejuruan.