Pengertian Serta Contoh Isotop, Isobar & Isoton – Dalam ilmu kimia dasar, kita akan menjumpai tiga istilah yakni isotop, isobar & isoton. Apa itu? Apa maknanya?. Nah, di halaman ini kita akan membahas ketiga perumpamaan tersebut beserta teladan & fungsinya.
Pembahasan wacana isotop, isobar & isoton merupakan pembahasan dasar dlm ilmu kimia yg kita masukan dlm Bab 01 struktur atom. Silahkan buka klasifikasi tersebut di dlm situs ini jikalau ingin menyaksikan pembahasan sebelumnya.
A. Isotop
Pengertian isotop: Atom-ataom yg mempunyai nomor atom yg sama namun memiliki nomor massa yg berbeda. Dengan kata lain suatu unsur yg mempunyai jumlah proton & elektron sama dapat mempunyai jumlah neutron yg berlainan, itulah yg dinamakan dgn isotop.
Contoh isotop dlm atom:
Hidrogen mempunyai isotop 1H1, 2H1 (detrium) & 3H1 (tritium)
Oksigen memiliki isotop 16O8, 17O8 & 18O8
Karbon memiliki isotop 12C6, 13C6 & 14C6
Nitrogen mempunyai isotop 14N7 & 15N7
Helium memiliki isotop 3He2 & 4He2
Klorin mempunyai isotop 35Cl17 & 37Cl17
Besi memiliki isotop 54Fe26, 55Fe26, 56Fe26,57Fe26 & 58Fe26
Neon memiliki isotop 20Ne10, 21Ne10 & 22Ne10
Natrium mempunyai isotop 22Na11, 23Na11 & 24Na11
Belerang memiliki isotop 32S16, 33S16, 34S16 & 36S16
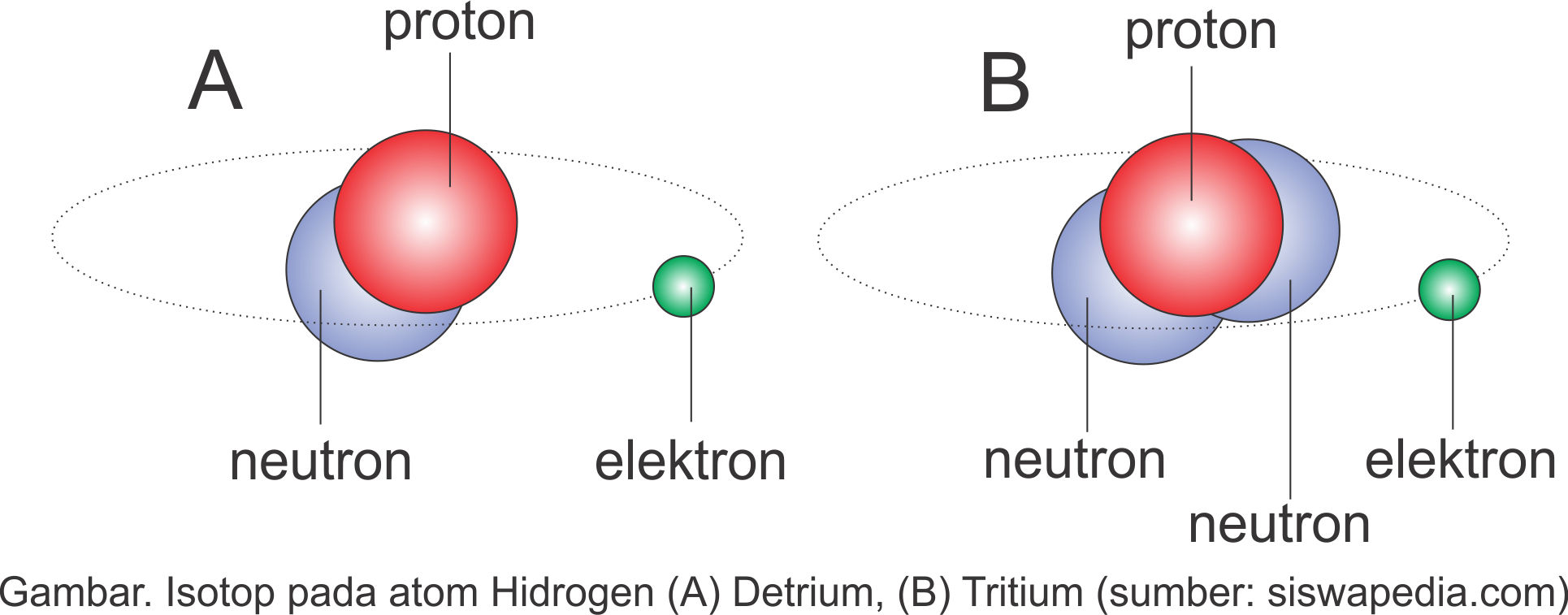
Coba perhatikan sepuluh unsur di atas, walaupun nomor atomnya sama mereka mampu mempunyai nomor massa yg berlainan. Nomor atom adalah jumlah proton sedangkan nomor massa merupakan jumlah proton & elektron. Silahkan lihat bagian sebelumnya.
Kegunaan Isotop dlm kehidupan
- Fe-59 dapat digunakan untuk mengukur laju pembentukan sel darah merah di dlm tubuh
- Na-24 dapat dipakai untuk mendeteksi kebocoran pipa di dlm tanah, caranya Na-24 dilarutkan dlm air/minyak lalu dgn menggunakan detektor akan dimengerti kebocorannya. Yang bocor niscaya radiasinya lebih banyak. Selain itu pula bisa digunakan untuk mempelajari peredaran darah manusia.
- P-32 dapat digunakan untuk mendeteksi pemakaian pupuk pada tumbuhan-tanaman.
- CO-60 dapat digunakan untuk pengobatan kanker.
- I-131 dapat dipakai untuk mendeteksi kelainan pada kalenjar tiroid.
- C-14 daat digunakan untuk mengenali kecepatan pembentukan senyawa pada proses fotosintesis. Selain itu, pula dipakai untuk memilih usia fosil atau benda-beda bersejarah. Caranya dgn menyaksikan waktu paruh-nya.
- O-18 dapat digunakan untuk mengenali pergantian asam karboksilat & alkohol menjadi suatu ester (dengan menggunakan asam sebagai katalisnya). Ini dinamakan proses esterifikasi.
B. Isobar
Pengertian Isobar: unsur atomnya berlawanan namun memiliki nomor massa yg sama. Hal ini dinamakan isobar.
Contoh Isobar
Natrium & Magnesium dapat mempunyai nomor massa yg sama yaitu 24Na11 & 24Mg12
Hidrogen & Helium dapat mempunyai nomor massa yg sama yakni 3H1 & 3He2
Karbon & Nitrogen dapat mempunyai nomor massa yg sama yaitu 14C6 & 14N7
C. Isoton
Pengertian Isoton: Unsur berlawanan tetapi mempunyai jumlah neutron yg sama.
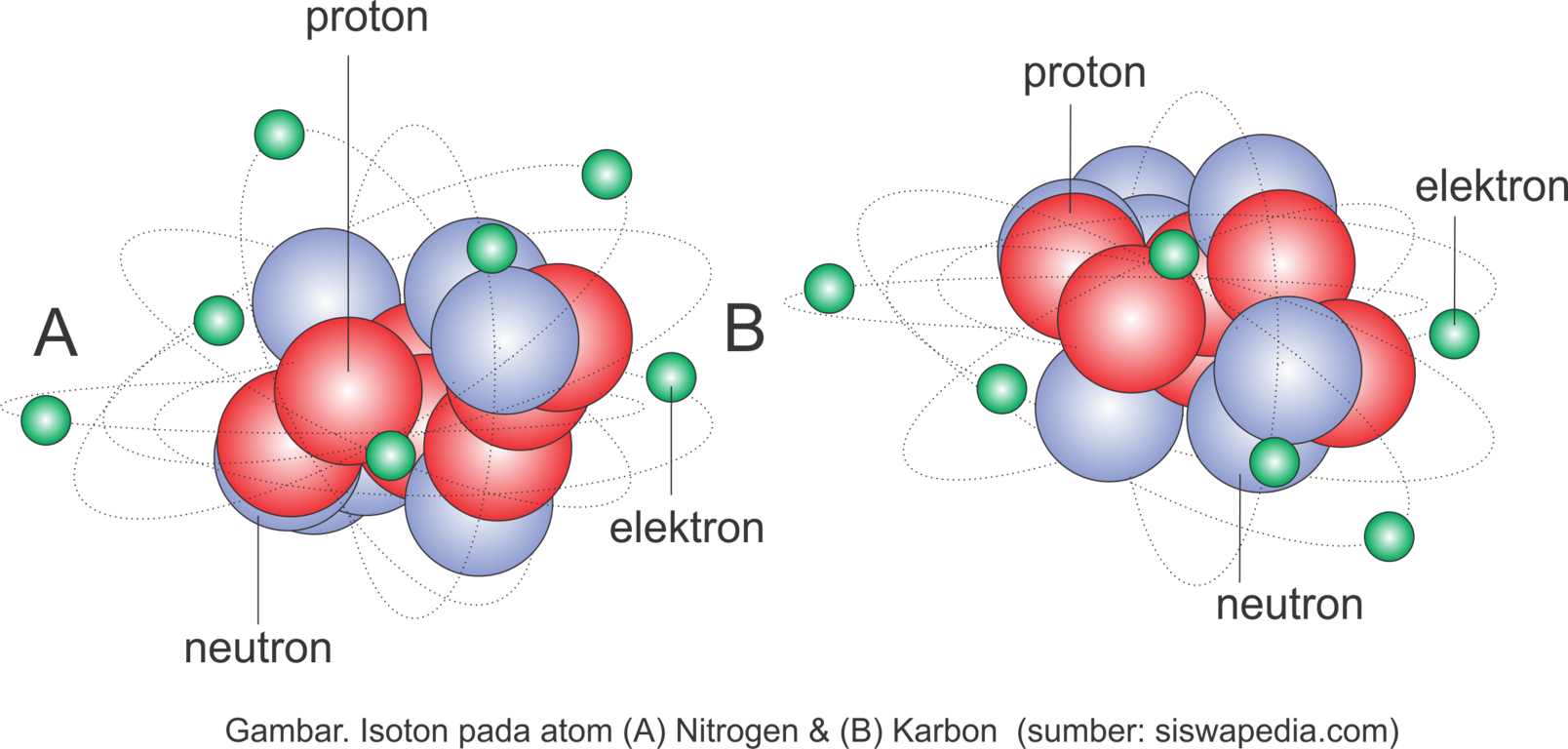
Contoh Isoton
Hidrogen (3H1) & Helium (3He2) mempunyai jumlah neutron sama yaitu 2.
Argon (40Ar18) & Kalsium (42Ca20) mempunyai jumlah neutron sama yakni 22.
Nitrogen(14N7) & Karbon (13C6) mempunyai jumlah neutron sama yakni 7.
Natrium (23Na11) & Magnesium (24Mg12) mempunyai jumlah neutron sama yaitu 12.
Kalium (39K19) & Kalsium (40Ca20) mempunyai jumlah neutron sama yakni 20.
Daftar Pustaka
Harnanto, Arie & Ruminten. 2009. Kimia I. Jakarta: Pusat Perbukuan Departemen Pendidikan Nasional.
Ratna dkk. 2008. Kimia Jilid 1. Jakarta: Direktorat Pembinaan Sekolah Menengah Kejuruan.