Pengertian & Rumus Satuan Mol – Untuk mempermudah dlm mengukur & mengetahui jumlah benda, kita membutuhkan satuan, contohnya 1 lusin untuk 12 barang, 1 kodi untuk 20 barang, & sebagainya.
Namun untuk benda yg relatif kecil & tak mampu dijumlah satu per satu, kita tak lagi memakai satuan lusin, kodi, maupun rim. Misalnya untuk beras, maka kita memakai kg atau gram.
Sama halnya dgn atom,
ukurannya yg sangat kecil pasti tak mudah kalau dihitung satu per satu.
Dibutuhkan suatu satuan yg dapat menunjukkan dgn sempurna jumlah atom
tersebut, baik di dlm reaksi maupun dlm kondisi tertentu.
Melalui aneka macam eksperimen yg dilaksanakan oleh para ilmuwan kimia terdahulu, didapatkan suatu satuan bernama mol. Satuan ini membuat lebih mudah peneliti khususnya tatkala akan mereaksikan suatu senyawa kimia.
Daftar Isi
Sejarah, Pengertian, & Hubungannya dgn Jumlah Partikel
Mol yaitu sebuah satuan yang
didapat dengan-cara matematis, melibatkan beberapa satuan lainnya seperti massa
molekul relatif, & massa atom rata-rata. Satu mol didefinisikan sebagai
jumlah partikel yg terkandung dlm suatu zat tertentu dimana jumlahnya sama
dengan banyaknya atom yg terdapat di dlm 12,00 gram atom C-12.
C-12 yakni isotop karbon yang
memiliki berat atom standar definitif sebesar 12. Oleh alasannya adalah itu massa isotop
karbon ini mempunyai berat tepat 12 gram. Penggunaan karbon selaku dasar
penentuan alasannya adalah karbon merupakan unsur yg paling sering & gampang ditemukan
di alam.
Sebuah percobaan pernah dijalankan
oleh ilmuwan berjulukan Joseph Loschmidt yg kemudian dibenarkan oleh Amedeo
Avogadro. Dari percobaan tersebut ternyata didapatkan bahwa bayaknya atom
karbon dlm 12,00 gram C-12 yakni 6,02 x 1023 atom atau partikel.
Kemudian bilangan ini dijadikan sebagai tetapan Avogadro atau disebut pula dgn bilangan avogadro dgn lambang L. Lambang tersebut diambil dr nama penemu Loschmidt.
Berdasarkan hal tersebut, maka
dapat ditulis:
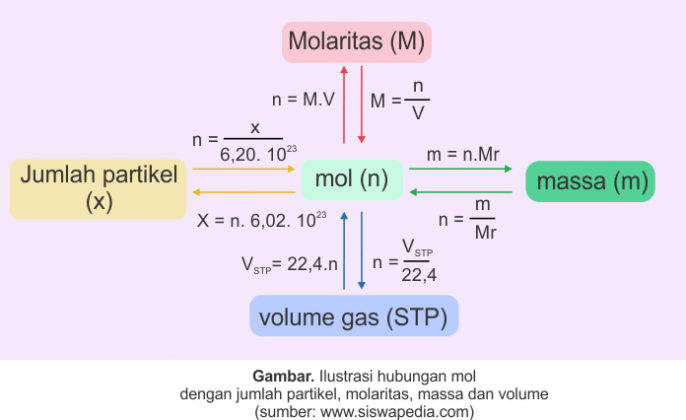
1 mol = 6,02 x 1023 partikel
Persamaan di atas dapat dipahami
sebagai jumlah partikel atau molekul setiap satu mol zat.
Hubungan Mol dgn Massa
Sebelum membicarakan tentang hubungan
mol dgn massa, perlu diketahui terlebih dulu ungkapan massa molar. Massa
molar menjelaskan kekerabatan antara jumlah partikel suatu zat dgn massanya.
Standar mol yg telah dibahas di atas menjadi dasar perhitungan massa molar
dengan massa atom relatif. Rumusnya mampu ditulis selaku berikut.

Massa 1 mol A = jumlah 1 mol atom A x massa rata-rata 1
atom A (persamaan 2)
=
6,02 x 1023 x massa rata-ata 1 atom A
Kemudian didapatkan persamaan :

Sedangkan massa 1 atom
C-12 dapat diputuskan dgn cara berikut :
12 gram atom C-12 = 6,02
x 1023 atom karbon,

kemudian persamaan 3
dan 4 dimasukkan ke persamaan 2, sehingga dapat diperoleh:

dengan begitu di
dapatkan massa 1 mol A = (Ar A) gram, satuan massa molar yakni gram/mol.
Hubungan mol dengan
massa mampu diterangkan melalui persamaan berikut ini:

Atau

n ialah jumlah mol
zat, a adalah massa zat dlm gram, & M ialah massa molar dlm gram/mol.
Hubungan dgn Volume
Di dlm kimia, kita mengenal
volume molar. Volume molar didefinisikan selaku volume 1 mol suatu zat yang
diukur pada suhu & tekanan tertentu. Apabila pengukuran ini dilakukan di suhu
0o & pada tekanan 1 atm, maka disebut selaku volume molar
persyaratan.
Perhitungan mampu dilakukan
dengan memakai persamaan berikut ini.

Keterangan:
V ialah volume gas pada suhu 0o & pada tekanan 1 atm,
n adalah jumlah mol gas.
22,4 L/mol di peroleh melalui
pengukurangan volume molar kriteria gas hidrogen (STP).
Daftar Pustaka :
Brown, Theodore L. et al. 2015. Chemistry: The Central Science (13th edition). New Jersey: Pearson Education, Inc.
Silberberg, Martin S. & Amateis, Patricia. 2015. Chemistry: The Molecular Nature of Matter and Change (7th edition). New York: McGraw-Hill Education