Partikel Penyusun Atom – Istilah Atom pertama kali diperkenalkan ke publik oleh Democritus yg diambil dr kata atomos dimana yg dlm bahasa Yunani a berarti tak & tomos berarti dibagi. Dengan kata lain atom merupakan partikel terkecil yg tak bisa dibagi lagi. Diameternya bisa sekitar 3 hingga 5 nm.
Hingga hari ini belum ada teknologi yg bisa memberi gambaran orisinil dr wujud atom dengan-cara terperinci. Para ilmuwan cuma bisa memprediksi kemudian menciptakan model atom berdasarkan sifat-sifatnya. Penelitian atom terus berkembang, aneka macam perubahan versi atom pernah dikemukakan oleh para jago. Misalnya saja teori atom Dalton, Thomson, Rutherford & Bohr. Kita akan membahasnya di halaman lain yg berjudul Perkembangan Teori Atom.
Apa sajakah partikel penyusun atom itu ?
Penggaris plastik merupakan materi yg tersusun dr atom. Apa itu materi? Silahkan baca artikel berjudul Materi & Wujudnya. Penggaris ini bila kita gosokkan ke rambut yg kering, maka akan mampu menawan sobekan-sobekan atau potongan kertas berukuran kecil. Darisini kita akan mengetahui bahwa penggaris plastik memiliki sifat listrik. Oleh karena penggaris plastic terdiri dr atom, maka bisa dikatakan bahwa atom mempunyai sifat listrik.
Sifat kelistrikan pada atom diteliti oleh para ilmuwan diantaranya J.J. Thompson, Eugen Goldstein, Ernest Rutherford, W. Bathe, H. Becker & James Chadwick.
A. Proton
Eugen Goldstein pada tahun 1886 melaksanakan percobaan dgn memodifikasi tabung sinar katode yg ditemukan oleh William Crookes dgn cara melobangi lempeng katode. Dari percobaan ini ditemukan bahwa gas yg berada di belakang katode menjadi berpijar. Hal ini berarti radiasi dr anode menembus lempengan katode lewat lubang yg sebelumnya telah dibentuk.
-
- Sifat sinar anode ini ialah:
Merupakan radiasi partikel karena bisa memutar baling-baling. - Radiasi ini bila dibelokkan menggunakan medan magnet, maka akan menuju ke kutub magnet negatif. Itu artinya radiasi sinar ini bermuatan positif (itulah sebabkan kemudian dinamakan anode yg kemudian dinamakan proton).
- Partikel sinar anode bergantung pada jenis gas yg ada di dlm tabung.
- Sifat sinar anode ini ialah:
Massa proton terkecil diperoleh pada atom Hidrogen adalah Massa 1 proton = 1 sma = 1,66 × 10-24 gram dgn muatan 1 proton = +1 = 1,6 × 10-19 C.
B. Elektron
Joseph John Thomson pada tahun 1897 melaksanakan percobaan dgn menggunakan tabung sinar katode. Terdapat dua plat elektroda dimana salah satu plat logam yg terdapat pada ujung tabung berfungsi selaku katoda. Kedua plat ini dimasukkan ke dlm tabung beling bertekanan rendah kemudian dialirkan listrik bertegangan tinggi hingga mampu melepas elektron dr katoda ke anoda.
Sinar katoda tak dapat kita lihat memakai mata telanjang tetapi kita bisa mengetahui bahwa sinar ini ada dr berpenjarnya lapisan tabung beling bagian dlm balasan adanya benturan antara elektron dgn dinding tabung. Atau kita bisa melihatnya bila sinar katoda kita benturkan ke layar ber-fluoresensi (layar yg mampu berpendar) setelah terlebih dahulu kita beri lubang pada plat logam anoda. Seperti gambar di bawah ini.
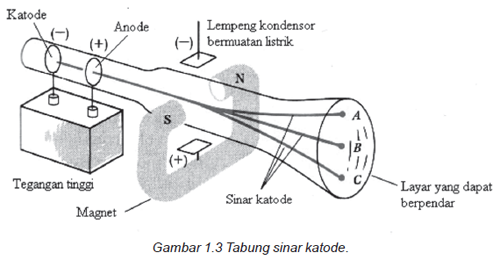
Dari hasil percobaannya didapatkan sifat sinar katode adalah:
-
- Merupakan radiasi partikel karena mampu memutar baling-baling.
- Radiasi ini bila dibelokkan memakai medan magnet, maka akan menuju ke kutub magnet positif. Itu artinya sinar katode bermuatan negatif.
- Partikel katoda merambat tegak lurus dr lempengan katode menuju anode.
- Sinar katoda tak tergantung pada jenis plat logam yg dipakai.
- Sinar katoda dapat kita buat dgn listrik tegangan tinggi.
Dari sifat inilah kemudian oleh J.J Thomson menamakan partikel penyusun atom bermuatan negatif ini sebagai elektron. Setelain ini J.J Thomson pula memperoleh perbandingan muatan elektron kepada massa yakni 1,76 × 108 C/g yg kemudian pada tahun 1909, Robert Millikan berhasil menemukan besarnya muatan suatu elektron adalah 1,6 × 10-19 C. Dengan demikian, maka kita peroleh massa 1 elektron sebesar 9,1095×10-31 Kg.
C. Neutron
Setelah ditemukan adanya proton di dlm inti atom, didapati bahwa ternyata massa inti atom senantiasa lebih besar daripada proton. Darisinilah kemudian para peneliti beropini bahwa ada partikel lain di dlm inti (selain proton) yg muatannya netral.
W. Bothe & H. Becker pada tahun 1930 melaksanakan penembakan memakai partikel alpha (α) ke inti atom berilium. Ditemukan adanya radiasi partikel yg mempunyai daya tembus besar. Dua tahun sesudahnya ialah tahun 1932, James Chadwick melakukan observasi lebih lanjut dimana didapatkan bahwa partikel tersebut bermuatan netral & mempunyai massa hampir sama dgn partikel proton (bermuatan positif). Partikel ini kemudian dinamakan selaku neutron.
Daftar Pustaka
Brown, Theodore L & Lemay, H. Eugene, J.R. 1977. Chemisty, The Central Science.
Prentice-Hall. Inc.
Harnanto, Arie & Ruminten. 2009. Kimia I. Jakarta: Pusat Perbukuan Departemen Pendidikan Nasional.
Permana, Irvan. 2009. Memahami Kimia I. Jakarta: Pusat Perbukuan Departemen Pendidikan Nasional.
Ratna dkk. 2008. Kimia Jilid 1. Jakarta: Direktorat Pembinaan Sekolah Menengah Kejuruan.