Memahami Unsur dlm ilmu Kimia – Unsur merupakan zat yg tak mampu diuraikan lagi menjadi zat yg lebih sederhana. Bila Anda telah membaca artikel berjudul materi & wujudnya niscaya Anda telah sedikit mengetahui perihal perumpamaan unsur ini.
Nah, pada halaman ini kita akan memfokuskan pembahasan mengenai unsur lebih dlm lagi antara lain terkait nama unsur, lambang unsur, nomor atom, nomor massa, isotop, isobar & isoton.
A. Nama Unsur
Nama unsur dlm bahasa Indonesia ada yg berlainan dgn nama unsur sesuai akad internasional (IUPAC), misalnya saja besi dinamakan Ferum, emas dinamakan Aurum, tembaga dinamakan Cuprum dsb. Untuk lebih jelasnya, bisa dikungjungi situs https://www.ptable.com/?lang=id atau bisa di lihat pada gambar di bawah ini.
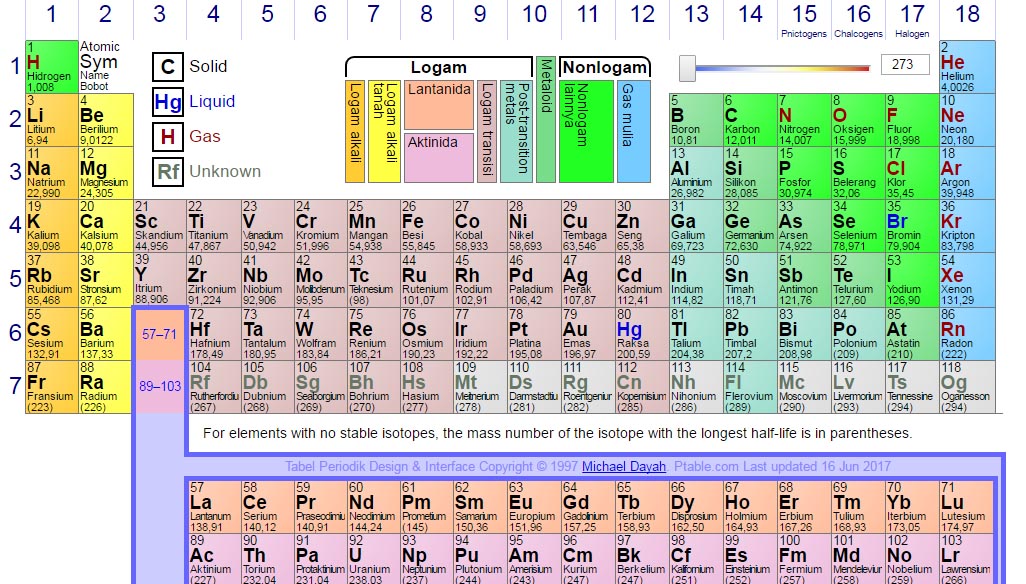
Nama unsur dlm tabel periodik unsur disusun menurut nama tempat/planet, tokoh ilmuwan atau menurut urutan nomor. Untuk penamaan berdasarkan nama kawasan misalnya Europium (Eu), Indium (In), Samarium (Sm), Amerisium (Am), Kalifornium (Cf), Moscovium (Mc), Plutonium (Pt) dll.
Adapun nama unsur yg dinamai menggunakan nama ilmuwan antara lain Rutherfordium (Rf), Curium (Cr), Einsteinium (Es), Mendelevium (Md), Lawrensium (Lr) dsb. Sedangkan yg menggunakan urutan nomor didasarkan pada akar kata pada bilangan yaitu nil = 0, un = 1, bi = 2, tri = 3 quad =4, pent = 5, hex = 6, sept = 7, okt = 8 & enn = 9 biasanya dipakai untuk menamai sementara sebuah unsur yg gres ditemukan.
B. Lambang Unsur
Dalam prakteknya, kita cukup sukar untuk menggunakan nama unsur dlm perhitungan kimia. Oleh alhasil, diharapkan penyederhanaan berupa singkatan yg dinamakan selaku lambang unsur. Jons Jacob Berzelius pada tahun 1813 sudah mencetuskan cara ini & tetap dipakai sampai kini.
Penamaan lambang unsur diambil dr huruf pertama sesuai nama dr IUPAC yg ditulis menggunakan abjad besar. Jika terjadi kesamaan dgn unsur yang lain, maka sebagian ditulis menggunakan dua huruf dimana pada abjad keduanya diambil dr karakter yg ada di nama unsur kemudian ditulis memakai huruf kecil. Misalnya, Hidrogen (H), Holmium (Ho), Hasium (Hs), Hafrinium (Hf) memiliki karakter awalan yg sama yakni huruf H, maka huruf kedua ditulis menggunakan aksara kecil.
Yang perlu dikenang yakni penulisan lambang unsur tak boleh ada yg salah. Hal ini mampu menyebabkan salaf tafsir, misalnya kita hendak menulis Cobalt yg lambang unsurnya Co. Nah, kalau kita menulisnya CO, maka akan menjadi senyawa karbonmonoksida, bukan Cobalt lagi.
C. Nomor Atom
Nomor atom merupakan jumlah atom kasatmata (proton) dlm suatu unsur. Setiap unsur berdasarkan Henry Moseley mempunyai jumlah yg berlawanan. Maka dengan-cara otomatis, nomor atom suatu unsur yg satu dgn yg lainnya berlawanan. Nomor atom diberi lambang Z.
Jika suatu atom mempunyai muatan netral, maka jumlah proton = jumlah elektro. Dengan begitu nilai Z = jumlah proton = jumlah elekton (e).
D. Nomor Massa
Nomor massa merupakan massa dr sebuah atom yg diberi lambang A. Massa atom merupakan massa proton + massa neutron + massa elektron. Dikarenakan massa elektron relatif sangat kecil, maka mampu diabaikan.
Massa proton = 1,673 x 10 -24 gram & massa neutron = 1,675 x 10 -24 gram. Sedangkan massa elektron sebesar 9,109 x 10-28 gram.
Nomor atom Z & nomor massa A ini diikutsertakan dlm penulisan lambang unsur. Jika lambang sebuah unsur yaitu X, maka penulisannya menjadi:
![]()
Untuk pembahasan isotop, isobar & isoton kita akan bahas pada halaman selanjutnya.
Daftar Pustaka
Situs www.ptable.com/?lang=id diakses pada tanggal 15 November 2017.
Ratna dkk. 2008. Kimia Jilid 1. Jakarta: Direktorat Pembinaan Sekolah Menengah Kejuruan.
Zulfikar. 2008. Kimia Kesehatan Jilid 1. Jakarta: Direktorat Pembinaan Sekolah Menengah Kejuruan.