Macam-Macam Gaya Antar Molekul Beserta Contohnya – Di dlm bahan ikatan kimia kita telah mempelajari bahwa suatu senyawa terbentuk lantaran atom-atom saling berikatan. Ikatan ini disebabkan lantaran adanya gaya tarik-menawan antar atom di dlm molekulnya. Apabila gaya ini diusik atau diberi sebuah aktivitas maka akan terjadi reaksi kimia.
Oleh karena itu, dlm pembahasan kali ini akan dipaparkan mengenai gaya antar-molekul. Gaya antar molekul ialah gaya tarik menarik antar molekul-molekul yg jaraknya berdekatan.
Baca juga: Macam-Macam Ikatan Kimia
Secara teori, gaya antar molekul memiliki gaya tarik yg lebih lemah dibandingkan dgn gaya intra molekul (gaya di dlm molekul). Selain itu gaya antar molekul mempengaruhi kepolaran masing-masing molekul & sifat fisisnya seperti titik beku, titik didih & titik leleh.
Daftar Isi
Macam-Macam Gaya Antar Molekul Beserta Contohnya
Ada berapa jenis gaya antar molekul? Berikut ini beberapa jenis gaya antar molekul yg harus anda pelajari.
1. Gaya London (Dispersi)
Apabila suatu elektron bergerak di dlm molekul maupun atom, gerakan tersebut acak sehingga menyebabkan elektron hanya berada di satu segi molekul atau atom tersebut. Keadaan tersebut membuat partikel menjadi dipol yg hanya berlangsung sesaat sehingga disebut dgn dipol sesaat.

Apabila di salah satu segi partikel terbentuk sisi negatif, maka sisi yg yang lain akan tertolak. Dengan kata lain, dipol sesaat mampu mensugesti dipol di dekatnya. Jika ada dua partikel yg memiliki dipol berlainan berdekatan maka akan terjadi tarikan sementara sehingga kedua partikel menyatu.
Pada atom bebas & molekul yg bersifat nonpolar, gaya tarikan ini sungguh lemah, yg disebut dgn gaya London. Gaya London terjadi di semua partikel. Namun, untuk senyawa ion, pengaruhnya bisa dikatakan sangat kecil kalau dibandingkan dgn gaya tarik menarik yg terjadi antar ion.

2. Gaya Van der Waals
Gaya antar molekul berikutnya ialah gaya Van der Waals. Nama gaya ini diambil dr nama seorang ilmuwan yakni Johannes Van der Waals. Gaya ini terjadi pada molekul-molekul yg terjadi dipol permanen misalnya pada molekul ionik & kovalen polar. Apabila molekul memiliki kutub yg sama maka keduanya akan tolak menolak. Sebaliknya, jika kutub keduanya berlainan maka akan tarik menarik.
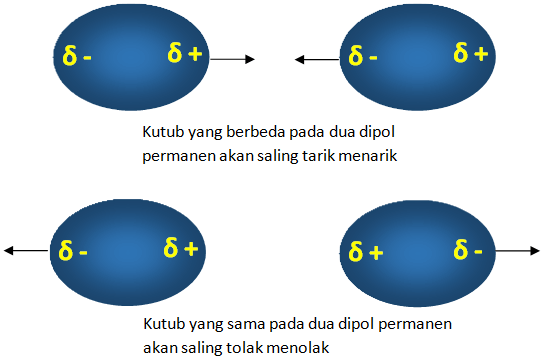
Gaya Van der Waals ini bila terjadi ini apabila terjadi pada molekul polar atau molekul-molekul dipol permanen, maka dinamakan sebagai gaya dipol-dipol. Nah, kian besar nilai momen dipol yg dimiliki molekul-molekulnya, maka akan kian besar gayanya.
Baca juga: Jenis-Jenis & Pembentukan Ikatan Kovalen
Contoh yang lain yakni antara molekul-molekul yg bersifat polar dimana terjadi dipol dengan-cara permanen. Hal ini menyebabkan senyawa polar dapat larut ke dlm pelarut polar. Sebagai teladan, asam asetat dapat larut di dlm air.
Terjadinya gaya ini yaitu sebagai berikut, mulaya dipol yg permanen tersebut mulai menginduksi lawan elektron molekul yg bersifat non polar. Akibatnya terbentuk dipol terinduksi. Adanya dipol terinduksi tersebut menjadikan molekul yg bersifat non polar bisa larut ke dlm pelarut polar meskipun sedikit. Contoh, oksigen yg larut di dlm air.

Nah, apabila interaksi tarik-menawan atau tolak menolak terjadi pada ion (baik itu kasatmata atau negatif) dgn molekul dipol permanen, maka dinamakan dgn gaya ion dipol.
3. Ikatan Hidrogen
Selanjutnya terdapat ikatan hidrogen. Ikatan ini merupakan gaya tarik mempesona yg terjadi antara atom hidrogen di dlm senyawa-senyawa yg terdapat ikatan antara hidrogen dgn atom N, O, & F. molekul polar seperi H2O mempunyai ujung-ujung yg muatannya saling berlawanan. Di dlm molekul, dipol menata dirinya sendiri sehingga sisi bermuatan konkret akan berdekatan dgn sisi yg negatif.
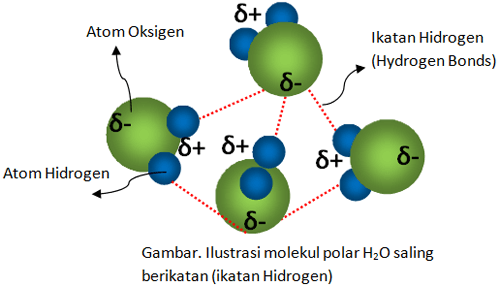
Kemudian tarikan dipol yg sungguh berpengaruh terjadi di antara molekul apabila mempunyai atom hidrogen yg terikat dgn Nitrogen, Oksigen, atau Fluorin. Ujung aktual dipol bisa mendekat ke arah ujung dipol negatif molekul lain, sehingga keduanya saling berdekatan & terjadi gaya tarik menawan yg sangat berpengaruh yg disebut dgn ikatan hidrogen. Kekuatan ikatan hidrogen mencapai 5-10% dibandingkan dengan ikatan kovalen.
Nah, bila ada pertanyaan terkait macam-macam gaya antar molekul beserta umpamanya di atas. Bisa ditulis dlm kotak komentar di bawah ini
Referensi:
Brady, James E. 1994. Kimia Universitas Asas & Struktur, terj. Edisi ke-5 Jilid 1. Jakarta: Erlangga.
Cotton and Wilkinson. 1989. Kimia Anorganik Dasar,terj. Jakarta: Penerbit Universitas Indonesia.