Daftar Isi
Apa itu pemahaman konfigurasi elektron ?
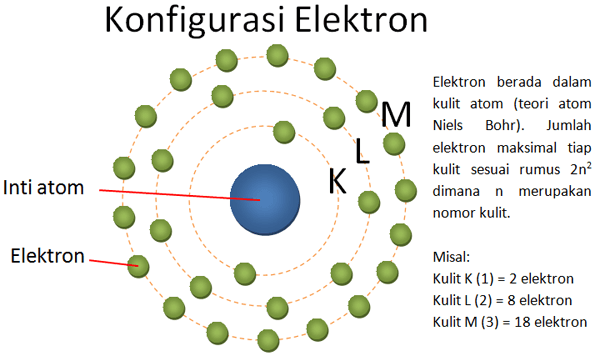
Konfigurasi elektron yakni sebuah penggambaran mengenai posisi elektron di dlm suatu atom. Namun sebelum memahami lebih lanjut mengenai konfigurasi elektron, terlebih dahulu kita ketahui teori atom & mekanika kuantum. Serta apa itu orbital?.
Orbital
Orbital yaitu tempat yg terletak di sekeliling inti atom dimana merupakan kemungkinan terbesar elektron bisa ditemukan. Terdapat banyak orbital di dlm atom yg masing-masing mempunyai ukuran, bentuk, maupun arah orientasi yg berlawanan & diputuskan oleh bilangan kuantum. Semua orbital tersebut tergabung menjadi satu membentuk subkulit. Subkulit pula bergabung menjadi kulit.
Dalam pembahasan kali ini kita akan mengenal kulit s, p, d, & f. Subkulit s tersusun atas orbital-orbital dgn bilangan kuantum l=0. Subkulit p tersusun atas 3 orbital yakni px, py, & pz serta bilangan kuantum l = 1. Subkulit d tersusun dr 5 orbital yaitu dxy, dyz, dxz, dx2-y2, & dz2.
Aturan Konfigurasi Elektron
Setiap atom memiliki konfigurasi yg khas atau tertentu. selaku pola, kalau terdapat atom Natrium di subkulit 1s, & terdapat atom Magnesium di subkulit yg sama, namun tingat energinya berlawanan. hukum-hukum lazim di bawah ini akan membantu memperkirakan penataan elektron suatu atom.
1. Aturan Aufbau
Dalam prinsi Aufbau, elektron akan stabil jika berada di tingkat energi yg lebih rendah. Dengan kata lain, elektron suatu atom cederung menempati subkulit yg mempunyai tingkat energi lebih rendah. Bagaimana mengenali besarnya tingkat energi subkulit?
Caranya ialah dgn mengetaui nilai bilangan kuantum utama atau n serta bilangan kuantum azimut atau l. kian besar nilai (n+l) maka makin besar nilai tingkat energi suatu orbital. Urutan energi orbital dr yg paling renda ke yg lebih tinggi adalah selaku berikut.
1s < 2s < 2p < 3s < 3p < 4s <3d < 4p < 4d …… & seterusnya.
2. Larangan Pauli
Larangan Pauli disebut pula Eksklusi Pauli. Dalam larangan tersebut dinyatakan bahwa elektron-elektron di dlm satu atom tak boleh atau tak bisa mempunyai nilai bilangan kuantum yg sama. Nilai n, l, & m mampu jadi sama tetapi nilai bilangan kuantum spin (s) mesti berlainan sebab dlm orbital cuma boleh terdapat dua elektron yg mempunyai spin atau arah putar yg bertentangan.
Larangan Pauli pula menyebutkan bahwa di dlm subkulit s cuma ada 1 orbital dgn jumlah maksimum elektron yakni 2. Di dlm subkulit p, terdapat 3 orbital & jumlah maksimum elektronnya yaitu 6. Subkulit d mempunyai 5 orbital dgn jumlah maksimum elektron yaitu 10. Sedangkan orbital f memiliki jumlah orbital sebanyak 7 dgn jumlah maksimum elektron yaitu 14.

3. Aturan Hund
Dalam suatu atom yg mempunyai jumlah elektron lebih dr satu, elektron-elektron tersebut akan menyebar & menempati orbital-orbital sesuai tingkat energi. Dalam aturan Hund menyatakan bahwa elektron-elektron tersebut tersebar ke seluruh orbital yg mempunyai spin yg sama atau sejajar. Dengan begitu elektron akan lebih stabil dibandingkan dengan menyebar dengan-cara acak.
Selain itu pula terdapat beberapa penyimpangan yg bisa terjadi pada suatu elektron di dlm atom. Penyimpangan pertama terjadi pada atom-atom yg berasal gari kalangan transisi. Elektron-elektron condong menempati orbital dengan-cara sarat atau setengah penuh untuk mencapai kestabilan.
Elektron pula mampu tereksitasi, atau berpindah ke tingkat energi yg lebih tinggi. Sehingga menghasilkan konfigurasi elektron yg berlainan dr konfigurasi sebelumnya yg lebih stabil. Peristiwa eksitasi ini terjadi misalnya tatkala suatu atom akan berikatan dgn atom lain.
Referensi :
Brady, James E. 1990. General Chemistry, (Principles & Structures). New York: John Wiley and Sons.
Chang, R. 2005. Chemistry. 8th ed. New York: Mc-Graw Hill.
Keenan, Charles E. et. al, – Pudjaatmaka. 1999. Ilmu Kimia Universitas (terjemahan). Jakarta: Erlangga.