Apa itu pemahaman ikatan kovalen ? apa saja jenis-jenis & pembentukan ikatan kovalen itu ?. Nah, untuk menjawab pertanyaan ini kita akan diskusikan seluruhnya di halaman ini.
Daftar Isi
A. Pengertian ikatan Kovalen
Ikatan kovalen merupakan ikatan yg terjadi alasannya adalah adanya pasangan elektron (e–) yg dipakai dengan-cara gotong royong oleh atom-atom yg berikatan.
Adapun pasangan elektron yg dipakai bantu-membantu dinamakan Pasangan Elektron Ikatan (PEI) sedangkan pasangan elektron yg tak terlibat atau ikut dlm pembentukan ikatan kovalen, kita namakan selaku Pasangan Elektron Bebas (PEB).
Ada lagi satu perumpamaan yg mesti dimengerti yaitu senyawa kovalen. Apa itu? senyawa kovalen merupakan senyawa yg cuma mengandung ikatan kovalen saja. Nah, ikatan kovalen itu sendiri lazimnya terjadi pada atom-atom bagian nonlogam baik itu sejenis maupun berbeda jenis.
Atom nonlogam sejenis misalnya O2, N2, Br2, F2, I2, Cl2 & H2. Atom yg berlainan jenis nonlogamnya, misalnya H2O, CO2 & sebagainya. Untuk mengenali macam-macam atom nonlogam, bisa dibaca wacana mengetahui bagian-unsur dlm kimia atau kalau temen-temen siswapedia ingin melihat tabel periodik komponen, mampu buka halaman ini: tabel periodik bagian.
Dalam menggambarkan ikatan kovalen ini kita mampu menggunakan rumus Lewis yaitu berupa sepasang titik o & x yg menggambarkan pasangan elektron ikatan (PEI) atau bisa pula memakai satu garis (-). Sedangkan untuk pasangan elektron bebas (PEB) digambarkan sebagai dua buah titik oo.
Masih gundah? amati acuan ikatan kovalen berikut ini.
a. H2

b. H2O

B. Jenis-jenis & pembentukan ikatan kovalen
Apa saja macam-macam atau jenis-jenis ikatan kovalen itu?. Biar lebih paham, kita akan bahas pula pola-pola ikatan kovalen beserta proses pembentukan ikatan kovalen.
Macam-macam ikatan kovalen berdasarkan jumlah PEI dapat dibagi menjadi tiga yakni:
a. Ikatan kovalen tunggal
Ikatan kovalen tunggal merupakan ikatan kovalen yg mempunyai 1 pasang PEI (Pasangan elektron Ikatan).
Contoh:
H2 & H2O mempunyai konfigurasi elektron H=1 & O=2,6
H2 ditulis H – H
H2O ditulis H – O – H
b. Ikatan kovalen rangkap dua
Ikatan kovalen rangkap dua merupakan ikatan kovalen yg mempunyai 2 pasang PEI (Pasangan elektron Ikatan).
Contoh:
O2, CO2 memiliki konfigurasi elektron O=2,6 & C=2,4
Untuk mencapai kestabilan, maka atom O mesti menerima 2 elektron. Nah, jika ada 2 atom O berdekatan, maka masing-masing akan saling memberi & mendapatkan dua atom sehingga O2 ditulis O = O
Untuk mencapai kestabilan, maka atom C (pada senyawa CO2) mesti membutuhkan 4 elektron sedangkan atom O memerlukan 2 elektron. Maka, atom C akan menggunakan bersama 2 elektron dr masing-masing atom O sedangkan pada masing-masing atom O akan memakai bareng 2 elektron dr atom C.
CO2 ditulis O = C = O
c. Ikatan kovalen rangkap tiga
Ikatan kovalen rangkap tiga merupakan ikatan kovalen yg memiliki 3 pasang PEI (Pasangan ikatan kovalen).
Contoh:
N2 mempunyai konfigurasi elektron N=2,5
Untuk mencapai kestabilan, maka atom N harus mendapatkan 3 elektron. Nah, jika ada 2 atom N berdekatan, maka masing-masing akan saling memberi & mendapatkan tiga atom sehingga menjadi N = N
Ikatan kovalen terjadi antara atom nonlogam yg satu dgn atom nonlogam lainya untuk meraih kestabilan sesuai kaidah duplet atau oktet. Jika temen-temen gundah terkait kaidah duplet atau oktet, maka bacalah artikel berjudul Ikatan Kimia.
Lalu, pertanyaannya: apakah kaidah duplet & oktet akan senantiasa berlaku?
Jawabannya adalah tidak. Coba amati gambar struktur Lewis pada PCl3 & PCl5 di bawah ini. (sumber gambar: Iman Rahayu dlm Praktis Belajar Kimia, hal.47)
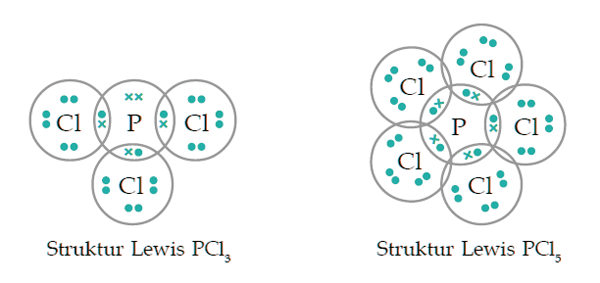
Atom P (Fosfor) memiliki 5 elektron terluar (valensi) sedangkan atom Cl (Klorin) mempunyai 7 elektron terluar. Untuk mencapai kesetimbangan atom P membutuhkan 3 elektron sedangkan atom Cl memerlukan 1 elektron lagi. Maka sesuai kaidah oktet, terbentuklah PCl3.
Namun, pada senyawa PCl5 hanya Cl sajalah yg menyanggupi kaidah oktet sedangkan atom P tak memenuhi sebab mempunyai elektron terluar berjumlah 10 elektron.
Contoh lainnya senyawa yg tak menyanggupi kaidah okted atau duplet ialah BF3.
Nah, terkait artikel jenis-jenis & pembentukan ikatan kovalen di atas, apakah ada pertanyaan?. Untuk halaman berikutnya kita akan membahas tentang macam-macam ikatan kovalen bedasarkan kepolaran ikatan yg diberi judul Ikatan Kovalen Nonpolar, Polar & Koordinasi.