Hukum Perbandingan Volume oleh Gay Lussac – Dalam banyak sekali ilmu kita membutuhkan teori-teori & aturan yg menerangkan bagaimana suatu ilmu bisa diterima. Salah satu contoh yakni ilmu kimia. Ada berbagai jenis hukum yg dipakai dlm kimia di mana hukum ini menjadi sumber lahirnya teori lain. Beberapa hukum kimia tersebut meliputi aturan perbandingan tetap, kelipatan perbandingan, kekekalan massa, & perbandingan volume.
Dalam pembahasan kali ini akan lebih detal menerangkan tentang hukup perbandingan volume yg ditemukan oleh ilmuwan bernama Gay Lussac. Hukum ini disebut pula dgn Hukum Gay Lussac, sesuai nama penemunya. Bagaimana sejarah Gay Lussac, penemuan, & aplikasi Hukum Perbandingan Volume? Berikut penjelasan selengkapnya.
Baca juga: Hukum Kekekalan Massa
Daftar Isi
Sejarah Joseph Louis Gay Lussac
Seorang mahir di bidang kimia & fisika berjulukan Joseph Louis Gay Lussac ini sudah berjasa dlm bidang kimia. Ia sudah menemukan suatu teori yg mendasari perkembangan teori kimia yg lain yakni Hukum Perbandingan Volume. Selain itu ia pula dikenal sebagai ilmuan yg berkaitan dgn gas.
Gay Lussac dilahirkan di Vienne tepatnya tanggal 6 Desember 1778. Di tahun 1802, Gay Lussac pertama kali mencetuskan sebuah aturan kimia yg merupakan hasil dr percobaannya. Dalam rumusannya, ia menyampaikan bahwa massa & volume suatu gas yg dipertahan biar tetap konstan akan besar lengan berkuasa pada tekanan gas.
Tekanan gas ini akan berkembangseiring dgn meningkatnya temperatur. Hukum ini pun dikenal dgn P = k T (P untuk tekanan, k untuk tetapan gas, & T untuk suhu dlm satuan Kelvin). Rumus ini pula bisa dipahami sebagai P/T = k. Kemudian dr rumus tersebut kita mengenal bahwa tekanan akan berbanding lurus dgn suhu.
Baca pula : Hukum-hukum dasar dlm ilmu kimia
Hukum ini bisa benar sebab temperatur atau suhu diukur dr rerata suatu energi kinetik dr zat. Energi kinetik tersebut akan meningkat apabila partikel-partikel bertumbukkan dgn pergerakan yg cepat. Hal ini akan kuat pada kenaikan tekanan.
Penemuan Hukum Perbandingan Volume
Untuk mampu merumuskan sebuah teori atau aturan di ilmu wawasan mirip kimia, maka diperlukan serangkaian observasi yg bisa menjelaskan teori tersebut nantinya. Gay Lussac tak menemukannya dlm satu kali observasi tetapi banyak sekali reaksi telah ia coba.
Ia memperoleh bahwa untuk setiap satu satuan volume suatu gas hidrogen ternyata bereaksi dgn 1 satuan volume gas Cl2 atau gas klorin. Reksi ini akan menciptakan 2 satuan volume gas HCl (hidrogen klorida). Sehingga perbandingan volume yg didapatkan yakni 1:1:2 untuk volume gas hidrogen, klorin, & hidrogen klorida dengan-cara berturut-turut.
Oleh alasannya itu, Gay Lussac balasannya berhasil merumuskan suatu hukum kimia yaitu selaku berikut.
“volume beberapa gas yg bereaksi & volume gas hasil reaksi tersebut apabila diukur di suhu & tekanan yg sama, maka akan berbanding menciptakan bilangan bundar & sederhana.”
Hukum ini kemudian menjadi suatu landasan yg penting bagi stoikiometri gas terbaru. Selain itu Hukum Gay Lussac menjadi dasar lahirnya hukum Avogadro yg pula membahas perihal suhu & tekanan pada suatu molekul.
Aplikasi Hukum Perbandingan Volume Oleh Gay Lussac
Untuk lebih mengerti hukum perbandingan volume, simak contoh penggunaannya di bawah ini.
Apabila anda mereaksikan 2 satuan volume gas hidrogen dgn 1 satuan gas oksigen, maka reaksi ini akan menghasilkan 1 satuan volume uap air (H2O). dr hasil ini maka akan diperoleh suatu perbandingan gas hidrogen, oksigen, & uap air yakni 2:1:2 yg ialah bilangan bulat & sederhana.
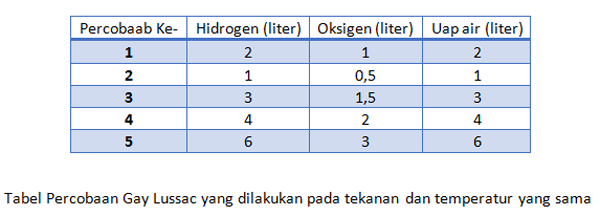
Sumber :
Brady, James E. 1990. General Chemistry, (Principles & Structures). New York: John Wiley and Sons.
Chang, R. 2005. Chemistry. 8th ed. New York: Mc-Graw Hill.
Keenan, Charles E. et. al, – Pudjaatmaka. 1999. Ilmu Kimia Universitas (terjemahan). Jakarta: Erlangga.