Hukum Perbandingan Tetap oleh Joseph Proust – Dalam ilmu kimia, kita mengenal beberapa teori & aturan yg mampu menjelaskan sebuah reksi kimia. Hukum tersebut lahir dr hasil penelitian para ilmuwan sheingga mendukung perkembangan ilmu kimia. Setidaknya terdapat empat hukum dasar kimia yg perlu anda ketahui yakni Hukum Kekekalan Massa, Hukum Perbandingan Tetap, Hukum Kelipatan Perbandingan, & Hukum Perbandingan Volume.
Dalam pembahasan kali ini, akan dijelaskan mengenai apa itu Hukum Perbandingan Tetap. Hukum kimia ini pertama kali dicetuskan oleh Ahli Kimia yg berasal dr Negara Prancis berjulukan Joseph Louis Proust. Secara ringkas, aturan Perbandingan Tetap membicarakan ihwal sebuah sifat senyawa tertentu. temuannya yakni perbandingan massa yg tetap pada komponen penyusun senyawa.
Baca juga: Hukum Kekekalan Massa Oleh Antonie L. Lavoisier
Daftar Isi
Sejarah Lahirnya Hukum Perbandingan Tetap
Sesuai dgn namanya, Hukum Perbandingan Tetap atau Hukum Proust didapatkan & dikemukakan pertama kali oleh Joseph Louis Proust. Serangkaian observasi telah dilakukan tepatnya mulai tahun 1797 hingga 1804. Konsep mengenai Hukum Perbandingan Tetap ini membuka jalan bagi dunia kimia untuk meningkat lebih pesat. Pada saat itu belum ada rancangan ihwal penyusun senyawa mirip H2O.
Kemudian pada tahun 1803, ilmuwan berjulukan John Dalton menggunakan Hukum Proust selaku dasar dlm pengembangan teorinya. Teori Dalton saat itu perihal atom. Sehingga lahirlah teori-teori baru yg hingga sekarang masih digunakan dlm kimia.
Aplikasi Hukum Perbandingan Tetap oleh Joseph Proust
aturan Perbandingan tetap atau pula diketahui dgn perumpamaan Hukum Proust. Hukum ini menjelaskan bahwa setiap senyawa kimia tersusun dr unsur-bagian yg memiliki perbandingan massa sama & tepat. Untuk lebih memahaminya, perhatikan teladan penerapannya berikut ini.
Jika terdapat sebuah sampel senyawa kimia, maka komposisi masing-masing komponen penyusunnya yakni sama. Sebagai pola, air (H2O) yaitu senyawa yg tersusun dr 8/9 massa oksigen serta 1/9 massa hidrogen. Sehingga dapat ditulis selaku 8:1.
Perhatikanlah tabel massa air yg dibentuk oleh hidrogen & oksigen berikut ini
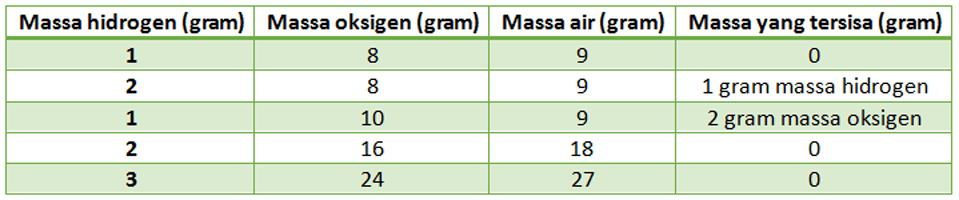
Perbandingan ini tetap walaupun air dibikin atau dibuat dr berbagai macam cara yg berbeda. Meskipun air dlm kondisi cair (liquid) atau gas, maka perbandingan akan tetap diperoleh sama. Jika hasil perbandingan berlainan maka tentu senyawa tersebut bukan air. misalnya, Hidrogen peroksida yg tersusun oleh hidrogen & oksigen juga. Namun memiliki perbandingan 1:16.
“Perbandingan massa komponen-komponen dlm suatu senyawa ialah tetap” (Hukum Perbandingan Tetap).
Adanya Hukum Proust atau Hukum perbandingan tetap ini memudahkan peneliti maupun jago kimia dlm pengukuran. Salah satunya yaitu dlm pengukuran massa komponen yg dibutuhkan untuk menciptakan suatu senyawa. Hukum ini pula memudahkan kita untuk mengetahui berapa massa sebuah komponen yg ada di dlm sebuah senyawa.
Penyimpangan Hukum Perbandingan Tetap oleh Joseph Proust
Hukum Perbandingan tetap banyak dipakai dlm penentuan massa sebuah unsur penyusun senyawa. Banyak ilmu dasar-dasar kimia modern yg membutuhkan teori ini. Namun ternyata ada beberapa pengecualian atau penyimpangan yg menjadikan aturan ini tak berlaku pada beberapa senyawa. Senyawa-senyawa yg tak memenuhi hukum Proust disebut sebagaI senyawa non stoikiometris.
Pada senyawa non stoikiometris, massa masing-masing komponen penyusunnya memiliki perbandingan yg berlainan, pun pada aneka macam sampel. Sebagai acuan yaitu senyawa oksida besi wustite. Senyawa ini di alam memiliki perbandingan massa antara 0,83 hingga 0,95 atom besi terhadap setiap atom oksigen.
Tidak hanya itu, untuk senyawa dgn koposisi isotop yg tak sama, maka aturan ini pula tak bisa digunakan untuk menentukannya. Perbedaan komposisi isotop sebuah senyawa dapat terjadi & dipakai dlm banyak sekali kebutuhan. Salah satu contohnya ialah penanggalan dengan-cara proses kimia. Polimer pula tak bisa memakai hukum proust alasannya adalah polimer memiliki rantai yg sungguh panjang.
Contoh Soal Hukum Perbandingan Tetap oleh Joseph Proust
Misalnya, untuk pembentukan amonia dibutuhkan komponen nitrogen & hidrogen dgn perbandingan massanya 14:3. Jika yg direaksikan yaitu 28 gram nitrogen dgn 9 gram hidrogen. Berapa massa amonia yg terbentuk serta berapa gram sisanya?
Nah, untuk menjawab alangkah baiknya kita buatkan tabelnya menjadi mirip di bawah ini.

Kemudian kita isi seperti pada tabel bewarna hijau di atas

Nah, gampang bukan?? jika ada pertanyaan seputar aturan perbandingan tetap, bisa di tulis di bawah ini.
Daftar Pustaka
Chang, R. 2005. Chemistry. 8th ed. New York: Mc-Graw Hill.
Keenan, Charles E. et. al, – Pudjaatmaka. 1999. Ilmu Kimia Universitas (terjemahan). Jakarta: Erlangga.