Daftar Isi
Memahami Hukum Kekekalan Massa Oleh Antonie L. Lavoisier
Hukum Kekekalan Massa Oleh Antonie L. Lavoisier – Antonie Laurent Lavoisier ialah spesialis kimia yg lahir pada tahun 1743. Ilmuwan yg berasal dr Prancis ini menerima julukan sebagai “Bapak Kimia Modern” dikarenakan telah mengemukakan penemuannya yg populer & teori-teori kimia modern. Salah satu teori Lavoisier yg paling populer ialah Hukum Kekekalan Massa.
Hukum yg mendasari banyak reaksi kimia ini merupakan aturan yg menyatakan bahwa sebuah massa (pada metode yg tertutup) akan tetap meski dlm reaksi terjadi beberapa proses. Makara, dgn kata lain, massa sebelum & sesudah reaksi adalah sama & tetap. Namun dgn catatan bahwa reaksi harus berlangsung atau terjadi pada tata cara tertutup.
Dahulu desain kekekalan massa sangat rumit untuk dipahami karena keterlibatan gaya Buoyan atau yg dikenal dgn gaya apung. Namun sesudah gaya ini dipahami dengan-cara mendalam barulah aturan kekekalan massa mampu dipelajari. Hukum kekekalan massa membuka teori-teori lainya sehingga membuka mata para alkemis terhadap kimia modern.
Baca juga: Memahami Unsur dlm Ilmu Kimia
Percobaan Lavoisier yg Mendasari Hukum Kekekalan Massa
Setiap teori & hukum kimia didapat berdasarkan pengamatan & observasi terhadap sebuah perubahan kimia. Hukum kekekalan massa yg dikemukakan oleh Lavoisier ini pun didapat dr hasil percobaan. Ia melalukan percobaan dgn memakai merkuri calx atau diketahui dgn merkuri oksida berwarna merah.
Pada mulanya, merkuri calx ini diposisikan di alat penghangat yg dihubungkan ke tabung penampung udara & hasil pemanasan. Kemudian zat tersebut dipanaskan pada suhu tertentu. hasil pemanasan selama jangka waktu tertentu ini ternyata menghasilkan gas oksigen (O2) & logam merkuri.
Kemudian, apabila pemanasan ini dibalik, yakni dilaksanakan pemanasan kepada oksigen & logam merkuri, maka akan dihasilkan senyawa merkuri oksida. Hasil ini menawarkan sebuah keunikan. Massa oksigen yg dihasilkan dr pemanasan merkuri calx sama dgn massa oksigen yg dibutuhkan untuk memanaskan logam merkuri untuk menghasilkan senyawa tersebut.
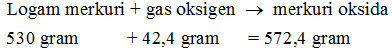
Dalam rangkaian alat yg dipakai oleh Lavoisier dlm percobaannya ini, ia memperoleh bahwa mula-mula tabung yg berisi udara A. Tinggi udara A ini kemudian dengan-cara perlahan-lahan mengalami peningkatan menjadi B. Hal inilah yg memberikan bahwa terdapat sebagian oksigen yg menyusut lantaran dipakai dlm pemanasan logam merkuri. Akibatnya terbentuklah merkuri oksida.
“Dalam reaksi kimia, massa zat-zat sebelum & sesudah reaksi yakni sama” ( Hukum Kekekalan Massa Oleh Antonie L. Lavoisier ).
Contoh Aplikasi Hukum Kekekalan Massa
Hukum kekekalan massa yg telah dikemukakan oleh ilmuwan Prancis berjulukan Lavoisier ini banyak digunakan dlm berbagai bidang. Beberapa bidang tersebut di antaranya ialah teknik kimia, kimia, dinamika fluidan, maupun mekanika.
Hukum ini mampu terjadi dlm reaksi pembentukan gas hidrogen & oksigen yg didapat dr air. prosesnya seperti ini: bila gas oksigen & pula hidrogen ternyata dibuat dr 36 gram air, maka tatkala reaksi terjadi sampai air bereaksi semuanya akan didapatkan produk dgn massa yg sama.
Namun jika pada reaksi tersebut ternyata menyisihkan air, maka total massa produk & air yg sisa yaitu tetap 36 gram. Perhatikanlah tabel berikut ini.
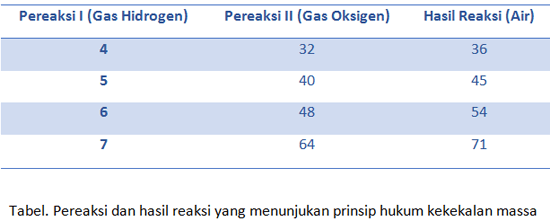
Penyimpangan aturan kekekalan massa pula mampu terjadi. Penyimpangan ini mampu ditemukan dlm reaksi kimia yg berjalan di dlm sistem terbuka. Mengapa?
Hal ini pastinya disebabkan karena adanya proses pergantian energi yg terlibat & terjadi sangat signifikan. Sebagai teladan, reaksi nuklir yg terjadi pada bintang dimana terdapat reaksi pelepasan sejumlah energi sungguh amat besar. Sedangkan di dlm sistem tertutup, energi tak dapat keluar ataupun masuk. Oleh lantaran itu tak ada pergantian energi yg bisa mengusik reaksi di dlm tata cara.
Baca juga: Hukum-aturan dasar dlm ilmu kimia
Daftar Pustaka:
Brady, James E. 1990. General Chemistry, (Principles & Structures). New York: John Wiley and Sons.
Chang, R. 2005. Chemistry. 8th ed. New York: Mc-Graw Hill.
Keenan, Charles E. et. al, – Pudjaatmaka. 1999. Ilmu Kimia Universitas (terjemahan). Jakarta: Erlangga.