Bentuk-Bentuk Molekul Beserta Gambarnya – Atom-atom yg berikatan membentuk molekul ternyata memiliki bentuk yg beragam. Molekul-molekul ini memiliki bentuk tiga dimensi yg mempunyai sudut ikatan yg berlainan akibat gaya tarik menarik di dlm molekul. Ikatan di dlm molekul tersebut disebabkan oleh adanya pasangan elektron.
Bentuk molekul ini bantu-membantu bisa dijelaskan dgn banyak sekali teori salah satunya yaitu teori hibridisasi orbital. Selain itu pula mampu dikenali melalui teori medan kristal atau Crytal Field Theory, & teori tolakan pasangan elektron atau yg dikenal dgn VSPR (Valence Shell Electron Pair Repulsion).
Penting untuk dikenali bahwa pasangan-pasangan elektron tersebut di dlm molekul akan memposisikan diri sedemikian rupa. Posisi ini terbentuk untuk meminimalisir penolakan yg terjadi antar pasangan elektron. Semakin jauh jarak pasangan elektron dgn yg yang lain maka kian kecil gaya tolak menolak antar pasangan elektron.
Daftar Isi
Bentuk-bentuk Molekul Beserta Gambarnya
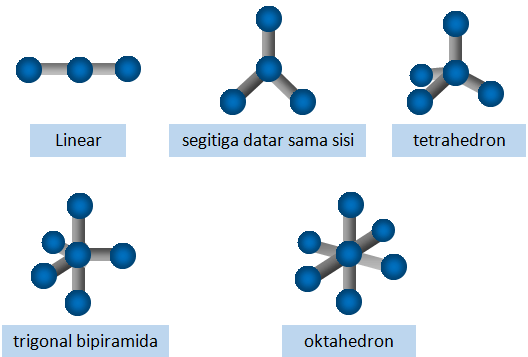
a. Bentuk Molekul Linear
Seluruh atom-atom yg menyusun molekul linear tersusun dlm daris lurus. Sudut yg dibentuk adalah 180 derajat dimana diproyeksikan oleh atom pusat dgn dua ikatannya. Sudut yg terbentuk ini disebut dgn sudut ikatan. Contoh molekul yg memiliki bentuk linear yaitu senyawa BeCl2.
Bentuk linear tersebut terjadi salah satunya karena atom pusat tak mempunyai pasangan elektron bebas, & hanya memiliki dua ikatan.
Baca juga: Sistem Periodik Unsur
b. Bentuk Molekul Segitiga Datar
Pada molekul yg berbentuk segitiga datar, terdapat tiga atom yg terikat ke atom sentra. Sudut-sudut yg dibentuk antara ikatan yg dgn ikatan yg lain yakni sama yaitu 120 derajat. Susunan semua atom tersebut membentuk segitiga sama sisi. Salah satu molekul yg memiliki bentuk segitiga datar adalah senyawa BCl3.
c. Bentuk Molekul Tetrahedron
Berbeda dgn bentuk molekul sebelumnya, untuk bentuk tetrahedron, terdapat empat atom yg terikat ke atom sentra sehingga membentuk bidang-bidang sekutu. Bidang ini merupakan segitga sama sisi yg berhimpit sehingga terbentuk sudut sebesar 109,5 derajat. Senyawa yg termasuk mempunyai bentuk tetrahedron yakni CH4.
d. Bentuk Molekul Trigonal Bipiramida
Bentuk molekul trigonal bipiramida merupakan molekul yg terbentuk dr bidang sekutu dr adonan limas segi tiga yg berhimpit satu sama lain. Terdapat lima atom yg terikat ke atom utama. Sudut yg terbentuk yakni 120 derajat untuk tiap ikatan yg berada di bidang segitiga. Sedangkan sudut 9 derajat untuk dua ikatan yg terletak diposisi vertikal. Contoh senyawa dr bentuk ini ialah PCl5.
Baca juga: teori-teori atom
e. Bentuk Molekul Oktahedron
Bentuk molekul oktahedron berasal dr 2 limas denang bantalan segi empat, dimana alasnya saling berhimpit satu sama lain. Oleh lantaran itu terbentuklah bidang segitiga berjumlah delapan. Dalam molekul oktahedron terdapat enam atom yg terikat ke atom sentra. Sudut ikatannya yaitu 90 derajat. Salah satu senyawa yg mempunyai bentuk oktahedron ialah SF6.
Cara Meramalkan Bentuk Molekul
Kita bisa meramalkan atau memperkirakan bentuk sebuah molekul. Bentuk-bentuk tersebut didapat dr hasil perhitungan. Namun terdapat cara yg lebih simpel yg bisa dijalankan yaitu selaku berikut.
Pertama-tama anda harus mengetahui valensi elektron atom-atom di molekul tersebut & kemudian menggambar rumus titik elektron. Kemudian anda jumlahkan seluruh elektron berpasangan dr senyawa anda tersebut. Jumlah elektron di sekitar atom pusat mampu menolong memilih bentuk dasar dr molekul.
Kemudian jumlah pasangan elektron mampu digunakan untuk menentukan bentuk bergotong-royong dr senyawa atau molekul yg sedang anda pastikan ini. Jika terdapat pasangan elektron bebas (belum berikatan) maka akan terjadi gaya tolak menolak lebih besar. Dengan kata lain sudut yg dibentuk lebih besar. Sehingga hal ini dapat mensugesti bentuk senyawa anda.
Referensi:
Brady, James E. 1994. Kimia Universitas Asas & Struktur, terj. Edisi ke-5 Jilid 1. Jakarta: Erlangga.
Cotton and Wilkinson. 1989. Kimia Anorganik Dasar,terj. Jakarta: Penerbit Universitas Indonesia.